细胞来源的细胞外囊泡(EVs)在成为生物源基因传递系统的过程,受到相对低效的装载策略的限制。来自瑞士苏黎世联邦理工学院的研究人员将EV与预装载的非层状溶致液晶脂质纳米颗粒(LCNPs)自发杂交,将各种核酸装载到小型EVs中,从而形成杂交EVs(HEVs)。研究表明,EV膜蛋白在HEV表面仍然可接触,其固有的酶活性在杂交过程后未受到影响;重要的是,HEVs在体外显示出比未杂交的LCNPs更高的核酸传递效率。这一多功能平台具有将各种核酸分子装载到原生EVs中的潜力,并可能有助于开发基于EV的治疗方法。相关内容以“Loading of Extracellular Vesicles with Nucleic Acids via Hybridization with Non-Lamellar Liquid Crystalline Lipid Nanoparticles”为题在线发表于2024年12月31日的国际知名综合性学术期刊Advanced Science杂志上。
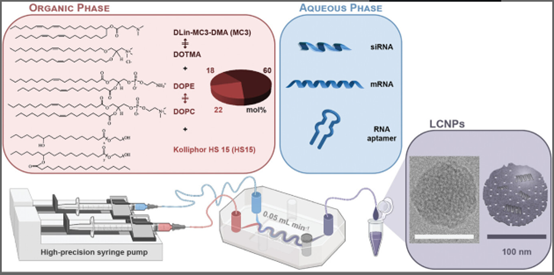
近年来,RNA治疗,如基于mRNA的疫苗和siRNA药物,受到了越来越多的关注,使得像COVID-19疫苗、patisiran/Onpattro或nusinersen/Spinraza等突破性药物得到批准。虽然寡核苷酸可以通过化学修饰来增强其“药物相似性”,并且通常以裸露形式或与靶向基序(例如N-乙酰半乳糖胺)结合的方式给药,但较大的核酸(NAs),如mRNA,通常需要封装在纳米载体内以促进其细胞内递送。脂质纳米颗粒(LNPs)因其制造简便、高核酸装载效率和良好的安全性而成为临床相关的核酸递送系统。然而,LNP领域目前面临两个阻碍其发展的障碍。一方面,系统注射的LNP缺乏组织特异性靶向,主要在单核吞噬系统(例如肝脏)器官中积累,这在治疗其他组织时需要高剂量的给药。其次,LNP与不必要的免疫反应和重复给药后的加速血液清除有关,这突显了开发更安全和更有效的LNP制剂的必要性。细胞外囊泡(EVs)是自然产生的细胞产生的囊泡,可能为解决LNP的一些局限性提供了有前景的途径。它们通过细胞外空间运输生物分子,如蛋白质和核酸,作为细胞间通信的重要介质。使用EV(例如来自间充质干细胞(MSCs))的临床试验突显了它们良好的耐受性,并且有证据表明,与LNP相比,EV可以更安全和有效地递送核酸。尽管如此,将治疗性核酸有效装载到小型EV(<200 nm)的腔内仍然具有挑战性。对EV生产细胞系的基因操作是将蛋白质或基于核酸的载荷引入EV的广泛使用的方法。然而,当处理从原代细胞或患者衍生的生物液体中获得的原生EV时,这种方法存在局限性,并且仅限于细胞自身可表达的核酸,无法操作化学修饰的核酸。因此,后分离装载方法更具多样性。它们通常通过物理或化学刺激暂时破坏EV膜,包括电穿孔、超声波、挤出、跨膜pH梯度和热震荡。其他策略包括对核酸的疏水性修饰(例如,使用胆固醇)以便附着到EV表面或与其他纳米载体(例如,含有脂质、聚合物或蛋白质材料的复合物或脂质体)相互作用及杂交(例如,Lipofectamine、Exo-Fect和聚乙烯亚胺(PEI))。尽管在EV的外源性装载方面进行了十多年的研究,但缺乏标准化的协议和对工程化EV产品的表征不足阻碍了其临床转化。实际上,有报告称某些外源性装载技术、EV转染试剂和用于纳米载体杂交的材料可能会对EV的物理和功能特性产生负面影响。受到这两个领域现有局限性的激励,研究人员报告了一种EV的外源性装载策略,达成两个主要目标:1)避免使用严苛的机械或化学处理,从而至少部分保留EV的功能和生物特性;2)有效地将核酸封装在EV内。在此背景下,研究人员使用非层状溶致液晶(LLC)脂质纳米颗粒(LCNPs)对原生MSC来源的EV进行转染,载荷包括siRNA、mRNA和RNA适配体。通过单颗粒表征技术,研究人员研究脂质纳米载体的物理化学特性、拓扑结构与其与小型EV融合/聚集倾向之间的相关性。结果显示,非层状脂质中间相通过在生理条件下简单共培养促进了LCNPs与EV之间的有效杂交。LCNP在pH 5时经历从反向六角(HII)相到pH 7.4时更无序的非层状相(可能是反向胶束(L2)或海绵(L3)相)的pH依赖性结构转变,这些相特别适合诱导与EVs的受控杂交过程。这种杂交方法消除了额外共挤出步骤的需要,这可能会损害核酸装载效率并促进EV腔内成分的损失。借助先进的光流体平台,研究证明MSC-EV膜蛋白位于形成的杂交EV(HEV)颗粒的表面,其固有的酶活性在过程中未发生改变。这代表了与基于电荷的杂交反应相比,HEV产品质量的显著改善,后者使用的永久带电阳离子脂质可能会对EV的物理化学特性和生物活性产生不利影响。最后,研究表明,最先进的单颗粒分析技术揭示,LCNPs在生理条件下与各种EV亚群体相互作用,并且约40%的HEVs装载了遗传物质。与EV的杂交可以提高siRNA和mRNA装载的LCNP的敲除或表达效率,特别是在具有挑战性的细胞培养条件下。参考文献:Loading of Extracellular Vesicles with Nucleic Acids via Hybridization with Non-Lamellar Liquid Crystalline Lipid Nanoparticles. Adv Sci (Weinh). 2024 Dec 31:e2404860.