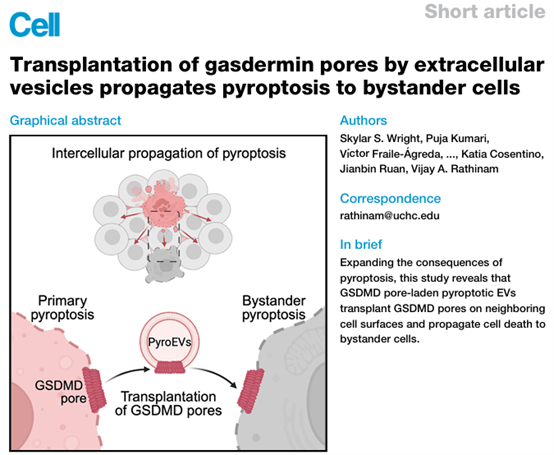
由成孔蛋白Gasdermin(GSDMs)介导的细胞焦亡在感染和炎症中发挥着关键作用。细胞焦亡触发炎症分子的释放,包括损伤相关分子模式(DAMPs)。来自美国康涅狄格大学的研究人员发现,细胞外囊泡(EVs)介导了细胞焦亡的细胞间传播,拓宽了细胞焦亡的病理学理论。相关内容以“Transplantation of gasdermin pores by extracellular vesicles propagates pyroptosis to bystander cells”为题在线发表于2024年12月26日的国际顶级学术期刊Cell杂志上。
细胞焦亡是一种由成孔蛋白Gasdermin(GSDMs)驱动的炎症性细胞死亡。在典型的细胞焦亡中,由炎症小体激活的caspase-1和caspase-11/4切割GSDMD——分离出形成孔的N端(GSDMD-NT)和自抑制的C端结构域。GSDMD-NT片段在质膜上组装成孔,导致基于ninjurin-1的细胞裂解,以及白细胞介素(IL)-1β、IL-18和损伤相关分子模式(DAMPs)的释放。在炎症小体反应中,IL-1β和IL-18已被广泛研究。细胞焦亡正逐渐成为同样关键的效应反应,在健康和疾病中发挥着重要作用。尽管细胞焦亡有助于对抗微生物和抗肿瘤免疫,但过度的细胞焦亡无疑会引发不必要的炎症,带来致命后果。此外,在脓毒症等疾病中,无法正常进行病原体感知和激活炎症小体的免疫细胞死亡,可能导致免疫反应失控,从而加剧免疫病理的发展,造成全身性炎症和器官损伤。然而,这些旁观者细胞(bystander cells)死亡的机制仍然很大程度上未知。同样,细胞焦亡对疾病发病机制的全部影响谱也不太清楚。在这项研究里,研究人员展示了细胞焦亡在体外和体内,从死亡细胞向旁观者细胞的细胞间传播。研究人员鉴定了由细胞焦亡细胞释放的细胞外囊泡(EVs),作为向初始细胞(naive cells)传播裂解死亡的传播者,促进炎症发生。DNA-PAINT超分辨率成像和免疫电子显微镜揭示了由细胞焦亡细胞释放的EVs上的GSDMD孔结构。重要的是,细胞焦亡的EVs在旁观者细胞的质膜上传递GSDMD并消灭了旁观者细胞。总体而言,该研究证明了GSDMD的细胞间囊泡传递,传播了细胞焦亡,揭示了与疾病相关的旁观者细胞死亡调控的多米诺效应。具体研究结果包括以下内容。1. 焦亡如何从死亡的细胞传播到旁观细胞(体外研究)首先研究团队通过在体外共培养条件下,诱导带有可诱导的GSDMD-NT(iGSDMD-NT)表达的骨髓来源巨噬细胞(BMDM-iGSDMD-NT)与野生型(WT)BMDM细胞共同培养。这些iGSDMD-NT细胞被用来触发焦亡。在共培养系统中,iGSDMD-NT细胞会因焦亡表现出细胞死亡标志(例如,DRAQ7染色,显示细胞膜破裂)。随着时间推移,WT BMDM细胞在与iGSDMD-NT细胞接触后也表现出类似的细胞死亡迹象。细胞死亡过程通过时间推移显现出一种传播效应:焦亡细胞的死亡传播至邻近的旁观细胞。细胞间焦亡的传播通过共培养模型被有效证明,揭示了焦亡不仅限于原发细胞,还能通过某些机制(如外泌体)扩展至其他细胞,形成一种多米诺效应,从而加剧炎症反应。2. 焦亡在小鼠体内如何传播至旁观者细胞通过注射E. coli(标记有AF647的LPS)到小鼠腹腔,研究发现尽管这些细胞没有直接感染,但在感染的区域周围,仍然有大量的旁观细胞(E. coli-AF647阴性细胞)表现出细胞死亡(PI染色阳性)。这表明焦亡的传播能影响到未直接暴露于感染的细胞。研究者将PBS或Dox处理过的CellBrite488标记的iBMDM-iGSDMD-NT细胞注射到小鼠腹腔。5小时后,检测到没有标记的细胞(即旁观细胞)也发生了死亡,这表明通过细胞间传播,焦亡从iBMDM-iGSDMD-NT细胞扩展至旁观细胞。研究人员进一步验证了转移细胞的焦亡传播。在CD45.1+WT BMDM细胞转移到Gsdmd-/-小鼠体内时,CD45.2+小鼠的腹腔细胞显示出焦亡现象。这是因为Gsdmd-/-小鼠中的细胞无法进行LPS诱导的焦亡,而外部转移的细胞则传递了焦亡信号,导致旁观细胞死亡。这些结果进一步证实了焦亡的传播不仅限于局部的细胞群体,而是能够通过细胞间的机制,扩展至周围未直接暴露的细胞,进而形成一个更广泛的炎症反应。3. 焦亡是否依赖于细胞间的直接接触来传播为了检验焦亡的传播是否依赖于细胞接触,研究者使用了Transwell系统,该系统将两组细胞分隔开,使其无法直接接触。当iBMDM-iGSDMD-NT细胞在上室通过Dox诱导焦亡后,下室的WT BMDM细胞也开始出现焦亡。这表明,尽管这些细胞无法直接接触,但焦亡依然能传播至下室的细胞。这部分研究揭示了焦亡的传播机制不依赖于细胞间直接接触,而是通过某种分泌因子来实现细胞间的传播。4. 焦亡细胞释放的细胞外囊泡(EVs)介导旁观细胞的死亡研究者通过大小排阻色谱(SEC)分离并筛选出具有细胞溶解活性的组分。通过进一步分析,发现该组分富含细胞外囊泡(EVs),这些EVs能够引起野生型BMDM细胞(BMDMs)死亡。从焦亡细胞(如经过nigericin刺激的WT BMDM细胞)分离出的EVs能够在不直接接触的情况下引发旁观细胞(如野生型BMDM、HeLa细胞、HEK293T细胞等)的死亡。研究发现,焦亡细胞释放的EVs含有活化的GSDMD(Gasdermin D),而GSDMD是引发焦亡的关键蛋白。通过免疫电子显微镜,研究者确认了GSDMD-NT(N端片段)存在于焦亡EVs的脂质双层上。进一步实验表明,从过表达活化GSDMD的293T细胞中分离的EVs能够引发旁观细胞死亡,这表明GSDMD在EV介导的焦亡传播中发挥了关键作用。5. EVs携带活化的GSDMD如何在旁观细胞中传播焦亡共聚焦显微镜成像显示,iGSDMD-NT信号主要集中在受体细胞的细胞膜上,这表明GSDMD-NT通过EVs的外膜传递到旁观细胞的膜上,从而引发焦亡。进一步的实验发现,当这些受体细胞接收到含有GSDMD-NT的EVs后,细胞表现出焦亡的特征。焦亡EVs携带的活化GSDMD不仅限于局部区域的传播,而是能在体内的不同细胞中传递。通过注射含有iGSDMD-NT-BFP标记的EVs到小鼠体内,研究人员观察到小鼠体内的细胞(如腹腔细胞)也能接收到这些EVs并出现GSDMD-NT信号。6. EV GSDMD的结构和功能研究发现,焦亡细胞释放的EVs上携带活化的GSDMD,并且GSDMD以孔道的形式存在于这些外泌体上。免疫电子显微镜(ImmunoEM)显示,GSDMD-NT在焦亡EVs的外膜上呈现出孔状结构。使用DNA-PAINT超分辨率显微镜技术,研究人员观察到焦亡EV中的GSDMD-NT形成了环状、弧形和线状结构,这些结构的形态和大小与在焦亡细胞膜上观察到的GSDMD孔道相似,表明这些孔道结构在EV上依然具有功能性。EV携带的GSDMD孔道能够融合并与旁观细胞的细胞膜结合,导致膜的破裂,进而诱发焦亡。焦亡EV在细胞之间传递GSDMD孔道,促使邻近细胞发生焦亡。7. 焦亡细胞EVs如何通过转移GSDMD孔道到旁观细胞,传播焦亡焦亡EVs通过膜修复机制转运GSDMD孔道。这些EVs可能是通过膜修复的ESCRT-III和ASM路径形成的,它们携带着GSDMD孔道,能够在细胞膜上进行转移。研究强调了焦亡的传播特性,焦亡EVs不仅通过细胞因子、损伤相关分子模式(DAMPs)和ASC specks等机制作用于旁观细胞,还能通过GSDMD孔道的转移直接引发旁观细胞的焦亡。这种传递机制可能在一些炎症性疾病(如脓毒症)中起到关键作用,导致大量旁观细胞的死亡,从而加剧疾病的进展。参考文献:Transplantation of gasdermin pores by extracellular vesicles propagates pyroptosis to bystander cells. Cell. 2024 Dec 26:S0092-8674(24)01334-5.
外泌体资讯网 Cell丨细胞外囊泡携带成孔蛋白GSDMs传播细胞焦亡