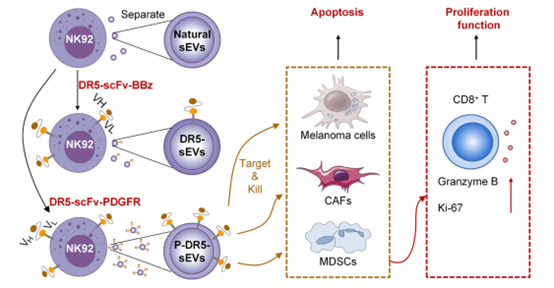
小型胞外囊泡(sEVs)是纳米级的囊泡。死亡受体5(DR5)介导外源性凋亡。美国宾州大学医学院徐小威研究团队在Science Advances杂志发表文章,设计了在自然杀伤细胞(NK细胞)衍生的sEVs表面表达DR5激动的单链可变片段(scFv)。PDGFR跨膜域将DR5-scFvs转运至sEVs表面。DR5-scFv sEVs能够快速诱导不同类型的DR5+癌细胞、骨髓来源的抑制细胞(MDSCs)以及癌相关成纤维细胞(CAFs)凋亡。DR5-scFv sEVs能够特异性迁移至体外和体内的DR5+肿瘤。系统性递送DR5-scFv sEVs显著抑制了DR5+黑色素瘤、肝癌和乳腺癌的生长,并延长了小鼠的寿命,同时未表现出明显的毒性。与DR5抗体相比,DR5-scFv sEVs在体内表现出显著更高的疗效。在器官型患者来源的黑色素瘤切片培养中,DR5-scFv sEVs能够有效抑制黑色素瘤细胞和MDSCs,并激活CD8+ T细胞。该研究表明,DR5-scFv sEVs能够通过靶向肿瘤微环境(TME)中的肿瘤细胞和免疫抑制基质细胞来抑制肿瘤生长。
嵌合抗原受体(CAR)T细胞疗法在血液恶性肿瘤治疗中取得了革命性进展。然而,其在治疗实体肿瘤中的效果仍存在疑问。CAR-T细胞疗法在实体肿瘤中的主要障碍包括CAR-T细胞对肿瘤的有限浸润、恶劣的肿瘤微环境(TME)以及T细胞的耗竭。此外,与通常表达特定表面标志物的血液系统恶性肿瘤不同,实体肿瘤表达的肿瘤相关抗原在正常组织中也有低水平表达。这增加了“靶向但非肿瘤特异性”毒性的风险,如Her2-CAR T细胞和GD2-CAR T细胞临床试验中观察到的严重毒性。因此,实体肿瘤治疗迫切需要更好的细胞疗法。小型胞外囊泡(sEVs)是相对稳定的纳米级囊泡,可以穿越生物屏障到达特定部位。sEVs具备其来源细胞的多种特性,并表现出出色的生物相容性。来源于细胞毒性免疫细胞(如自然杀伤细胞[NK细胞]、CD8+T细胞和γδ T细胞)的sEVs可携带穿孔素、溶酶体酶及其他细胞毒性分子,并将其传递至癌细胞。然而,未经过改造的免疫细胞所分泌的sEVs缺乏肿瘤靶向能力。由CAR-T细胞释放的sEVs在其表面携带CAR,并在临床前模型中对某些癌症展示了有希望的靶向和治疗效果。死亡受体5(DR5)是肿瘤坏死因子相关的凋亡诱导配体(TRAIL)的受体。DR5在多种癌症中高度表达,如肝癌、黑色素瘤和胰腺癌,而在正常组织中的表达量显著较低。DR5也在肿瘤微环境(TME)中的主要免疫抑制细胞——骨髓来源的抑制细胞(MDSCs)中高度表达。DR5的激活会诱导细胞凋亡,因此DR5及其相关死亡受体是癌症治疗中具有吸引力的靶点。尽管癌症患者对DR5促效抗体耐受性良好,但接受治疗的患者中肿瘤缩小的情况较为罕见。NK细胞是能够强效杀伤肿瘤细胞的先天免疫细胞。NK细胞株NK92因其安全性特征已被广泛研究并用于临床试验。NK92细胞属于CD56bright NK细胞亚群,能够分泌大量免疫调节因子,包括干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)。来源于NK92细胞的sEVs已被报道含有细胞毒性蛋白并具有抗肿瘤作用。在体内注射NK92细胞来源的sEVs可抑制小鼠B16F10黑色素瘤的生长。
DR5-scFv sEVs重编程肿瘤微环境(TME)的示意图该研究改造了NK92细胞,使其能够分泌在表面携带DR5激动的单链可变片段(scFvs)的sEVs。血小板衍生生长因子受体(PDGFR)的跨膜域比CD8跨膜域更高效地将DR5-scFvs转运至sEVs表面。活细胞成像研究表明,DR5-scFv sEVs能够快速诱导DR5+黑色素瘤细胞的凋亡。改造后的sEVs在体外和体内能够特异性迁移至DR5+黑色素瘤细胞。系统性递送DR5-scFv sEVs显著抑制了多种癌症的生长,并延长了接受治疗小鼠的寿命,同时未观察到不良反应。与DR5抗体相比,DR5-scFv sEVs对DR5+癌细胞在体外和体内的细胞毒性显著更高。此外,DR5-scFv sEVs显著抑制了肿瘤微环境(TME)中的MDSCs和癌相关成纤维细胞(CAFs),并在患者来源的黑色素瘤切片培养模型中激活了CD8+ T细胞。综上所述,DR5-scFv sEVs通过靶向TME中的肿瘤细胞和免疫抑制基质细胞抑制了肿瘤的生长。
DR5-scFvs诱导DR5+肿瘤细胞凋亡小型胞外囊泡(sEVs)体积约为T细胞的百万分之一,与CAR-T细胞相比,sEVs能够更容易穿过肿瘤微环境(TME)的免疫屏障,进入免疫特权部位及实体肿瘤。该研究显示,虽然DR5 CAR-T细胞在裸鼠模型中通过瘤内注射有效控制了A375黑色素瘤的生长,但全身递送效果有限。而通过全身递送的DR5-scFv sEVs在多种实体瘤模型中表现出显著的肿瘤控制效果,并具有类似CAR-T细胞的肿瘤靶向能力。与DR5抗体相比,DR5-scFv sEVs表现出更高的细胞毒性,同时对MDSCs和癌相关成纤维细胞(CAFs)具有显著抑制作用,并能激活CD8+ T细胞,提高免疫响应。DR5-scFv sEVs结合了sEVs天然优势及DR5-scFv的特性,能够特异性靶向DR5+肿瘤细胞,诱导其凋亡,同时保护scFv免受循环中降解。通过将更多DR5-scFvs加载到sEVs表面,可显著提高肿瘤杀伤效果。与CAR-T细胞不同,sEVs递送不需要淋巴清除,因此副作用更少。此外,NK92细胞来源的sEVs还携带穿孔素、颗粒酶等细胞毒性分子,以及细胞因子、趋化因子和miRNA等信号分子,可重编程TME,增强抗肿瘤炎症反应。NK92细胞具有易于工程改造和批量生产的特点,且已获美国FDA批准用于癌症免疫治疗。这种基于NK92细胞的sEVs生产方法不仅能降低制造成本,还能显著减少批次间的差异。然而,目前sEVs在纯化和临床应用中仍面临挑战,包括缺乏标准化的分离及纯化方法、低产量和产品异质性等。此外,针对sEVs的监管要求尚不明确,但已有66项sEVs相关临床试验正在进行中,显示其治疗潜力。
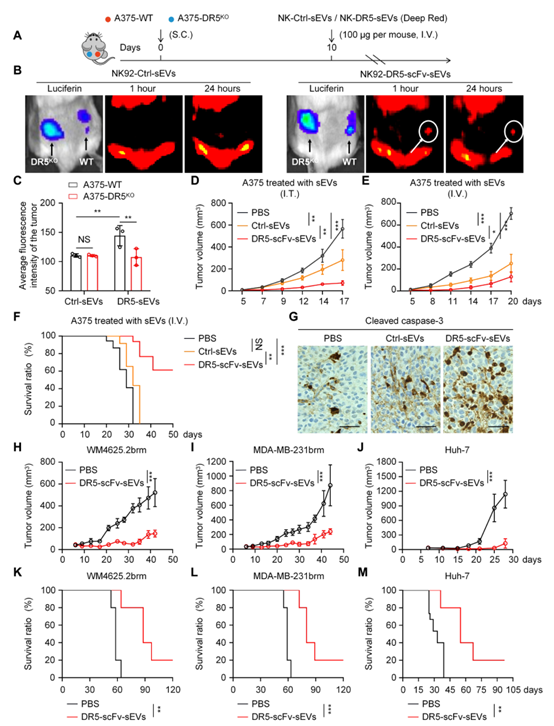
DR5-scFv sEVs迁移至DR5+黑色素瘤并在体内抑制肿瘤生长总之,该研究开发了一种高效表达DR5-scFvs的工程化sEVs,能够特异性靶向DR5+肿瘤细胞、MDSCs和CAFs,缓解免疫抑制性TME,恢复其他免疫细胞的正常功能。这种“即用型”sEVs平台可通过加载不同scFvs靶向多种癌症,为实体瘤治疗提供了一种通用的免疫疗法解决方案。参考文献:Guo Y, Wang H, Liu S, Zhang X, Zhu X, Huang L, Zhong W, Guan L, Chen Y, Xiao M, Ou L, Yang J, Chen X, Huang AC, Mitchell T, Amaravadi R, Karakousis G, Miura J, Schuchter L, Flowers A, Zheng Q, Mou H, Gimotty P, Herlyn M, Guo W, Xu X. Engineered extracellular vesicles with DR5 agonistic scFvs simultaneously target tumor and immunosuppressive stromal cells. Sci Adv. 2025 Jan 17;11(3):eadp9009. doi: 10.1126/sciadv.adp9009. Epub 2025 Jan 15. PMID: 39813334.