缺血性脑卒中已成为世界第二大致死及致残原因的重症疾病,给患者及家庭和社会带来沉重的经济及医疗负担。卒中后血脑屏障的破坏使外周血内的细胞及炎症因子等成分进入脑实质浸润,加剧神经元的炎症损伤,恶化神经功能的恢复。迄今为止,缺血性脑卒中的治疗手段仍十分有限,疗效仍不尽人意。重组组织型纤溶酶原激活剂(r-tPA)是FDA唯一批准的急性脑卒中患者血管内溶栓药,然而它的应用具有严苛的时间窗及禁忌症,并有脑出血转化的风险,且血管再通率不超过35%,难以使大量患者从中获益。此外,血管内机械取栓术作为急性大血管脑梗死的血管内介入治疗手段,取栓后仍有一部分患者预后不佳。因此,迫切需要开发作用机制明确的创新疗法。骨髓间充质干细胞来源小细胞外囊泡(BMSCs-sEVs),作为新兴的生物纳米药物,可跨越血脑屏障,已被广泛报道从多方面对缺血性脑卒中发挥治疗作用,然而其对于血脑屏障的保护及机制目前并不十分明确。近日,澳门大学中华医药研究院赵永华助理教授团队在International Journal of Biological Sciences (Q1, IF: 8.2)发表题为“BMSCs-derived small extracellular vesicles antagonize cerebral endothelial Caveolin-1 driven autophagic degradation of tight-junction proteins to protect blood-brain barrier post-stroke”的研究论文(2025 Jan 1;21(2):842-859),探讨了骨髓间充质干细胞来源小细胞外囊泡(BMSC-sEVs)在缺血性脑卒中后对血脑屏障的保护作用,并揭示了其治疗机制与拮抗脑内皮细胞Caveolin-1介导的紧密连接蛋白ZO-1和Occludin内吞自噬降解密切相关。澳门大学中华医药研究院博士生李易阳为第一作者,赵永华助理教授为文章的通讯作者。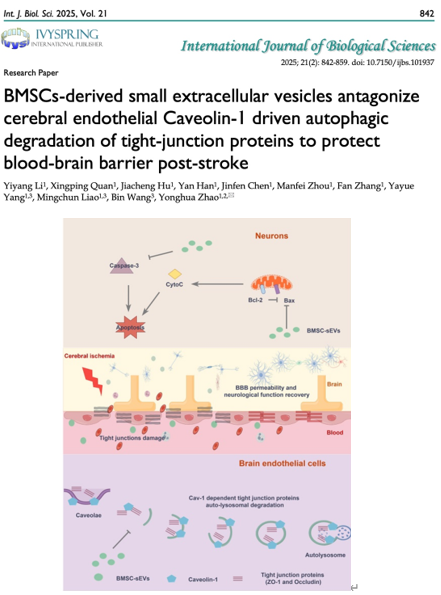
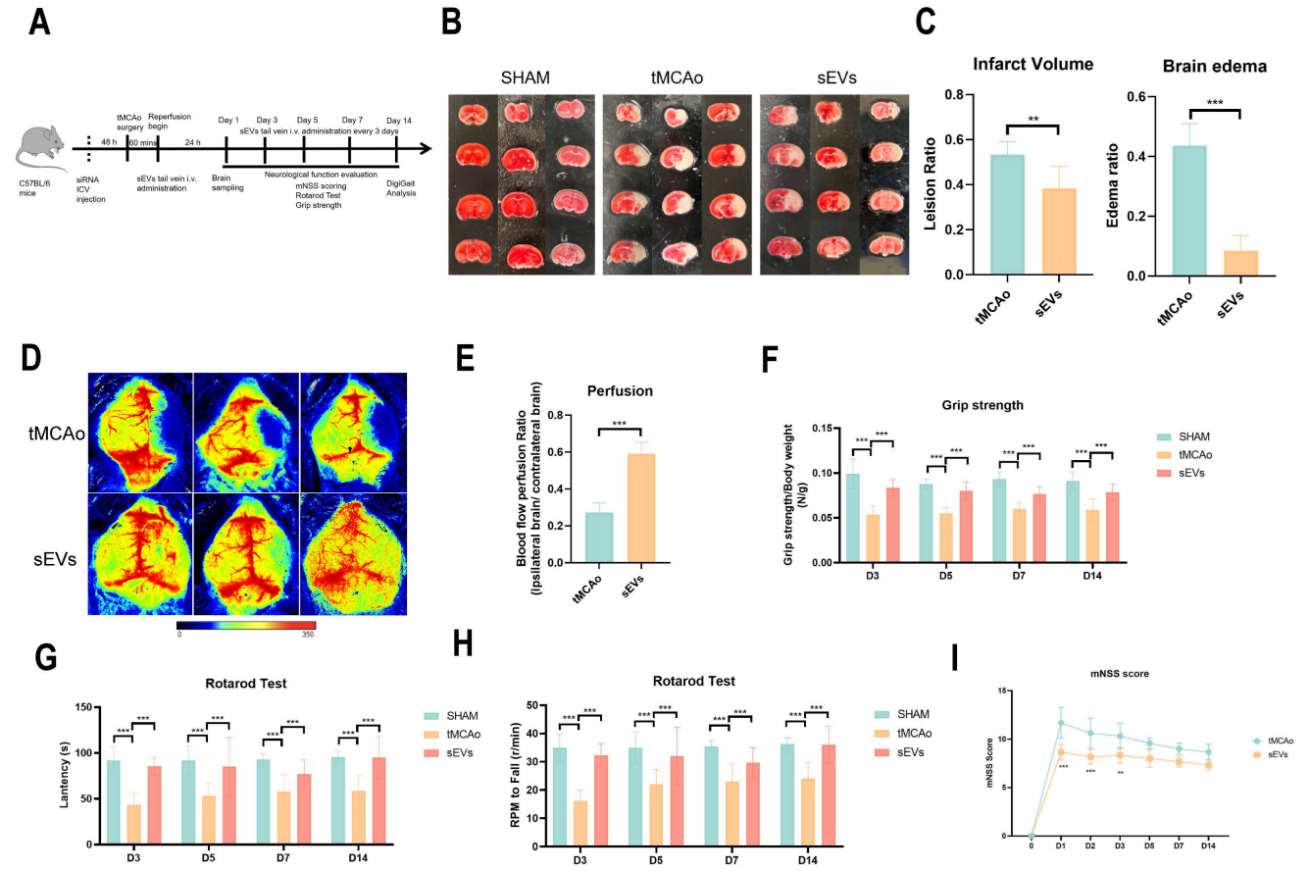
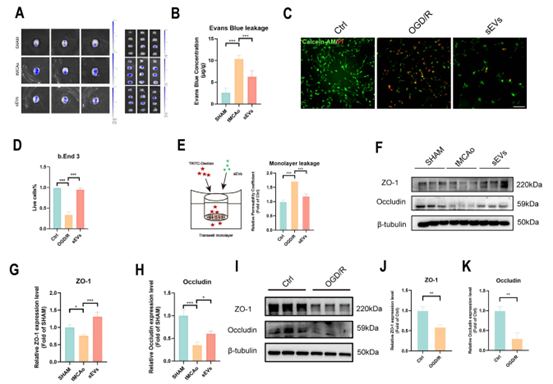
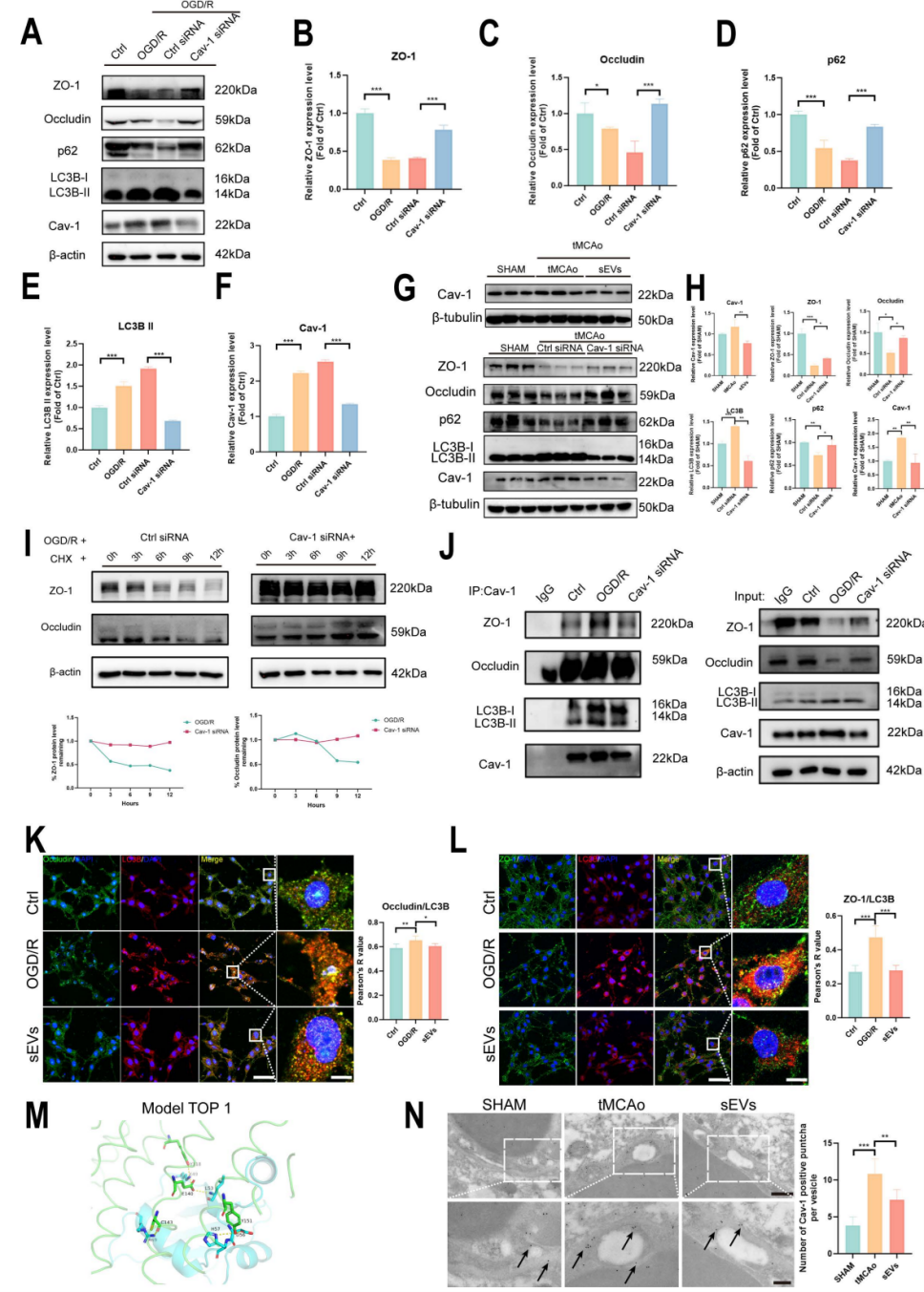
图一. BMSC-sEVs通过抑制脑内皮细胞Caveolin-1介导的紧密连接蛋白ZO-1和Occludin内吞自噬降解保护卒中后血脑屏障和神经元研究者首先通过超速离心法分离了BMSC-sEVs,并利用纳米粒径分析(NTA)、透射电镜(TEM)及细胞外囊泡标志物对小细胞外囊泡进行了表征,并验证了DiI标记的BMSC-sEVs可跨越血脑屏障被内皮细胞及神经元摄取。接着,在短暂大脑中动脉阻塞小鼠模型(tMCAo)中,BMSC-sEVs的给药显著减小tMCAo小鼠的脑梗死面积及血脑屏障渗漏,同时大幅改善小鼠步态行为学表现及神经功能,减少神经元的凋亡;在体外糖氧剥夺/复氧(OGD/R)脑内皮及神经元细胞模型上,BMSC-sEVs的治疗显著恢复脑内皮细胞紧密连接蛋白ZO-1和Occludin的表达,降低单层细胞屏障的渗漏,同时抑制神经元的凋亡;此外,BMSC-sEVs的给药明显抑制缺血性脑卒中后脑内皮细胞的自噬流,并下调Caveolin-1的表达。图二. BMSC-sEVs改善tMCAo小鼠脑梗死面积及神经功能图三. BMSC-sEVs保护卒中后血脑屏障的完整性最后,研究者使用Caveolin-1 siRNA转染,放线菌酮(CHX)蛋白降解实验,免疫共沉淀(Co-ip)及免疫电镜等技术验证了脑内皮细胞Caveolin-1 在紧密连接蛋白ZO-1和Occludin内吞自噬降解中起到不可或缺的作用,并且证实了BMSC-sEVs对卒中后血脑屏障的保护作用与此机制密切相关。图四. BMSC-sEVs通过拮抗脑内皮细胞Caveolin-1介导的紧密连接蛋白内吞自噬降解保护血脑屏障完整性该研究首次阐明了BMSC-sEVs保护缺血性脑卒中后血脑屏障的新机制,并为脑卒中细胞外囊泡疗法走向临床转化提供了新的理论依据。BMSCs-derived small extracellular vesicles antagonize cerebral endothelial Caveolin-1 driven autophagic degradation of tight-junction proteins to protect blood-brain barrier post-stroke. Int J Biol Sci 2025; 21(2):842-859.致谢:本研究得到国家自然科学基金(No. 82074051),广东省自然科学基金 (No. 2023A1515010034), 及澳门大学校内研究项目(MYRG2022-00221-ICMS)资助。外泌体资讯网 Int J Biol Sci|澳门大学赵永华:骨髓间充质干细胞衍生的小细胞外囊泡拮抗脑内皮紧密连接蛋白自噬降解保护卒中后血脑屏障