细胞外囊泡(Extracellular vesicles, EVs)是一种由细胞分泌的囊泡状结构小体,广泛存在于血浆、尿液等各种体液中,作为细胞间一种新兴的信号传导媒介,对细胞外囊泡的精准分离、制备及生物学功能研究是目前分析化学和生物医学领域的研究前沿和热点。由于细胞外囊泡在复杂生物样品中丰度较低,同时从复杂生物样本中获取高纯度细胞外囊泡极易受蛋白质等纳米级污染物阻碍,因此对分离制备工具提出极大挑战。目前细胞外囊泡的分离和制备方法如超速离心法、尺寸排阻色谱法、免疫亲和捕获法、膜分离法等,但这些方法普遍均存在纯度低、回收率低、产量低、通量有限、易堵塞等难题。因此,研发纯度高、产量高的普适性细胞外囊泡制备方法用于临床诊断及治疗十分必要。近日,延边大学李东浩教授课题组在ACS出版Analytical Chemistry杂志上发表题为“Simultaneous Isolation and Preparation of Extracellular Vesicles by Circular Multicavity Electrophoresis”的论文,提出一种基于连续梯度非均匀电场结合梯度凝胶孔径分布的靶型多腔电泳装置(Circular Multicavity Electrophoresis,CME)实现细胞外囊泡的分离制备。延边大学李东浩教授、青年教师刘璐、任香善教授为本论文通讯作者,延边大学交叉学科硕士研究生邢宇航为本论文第一作者。
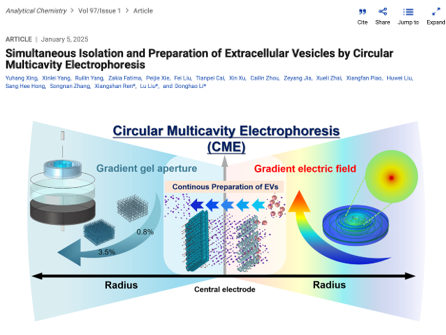
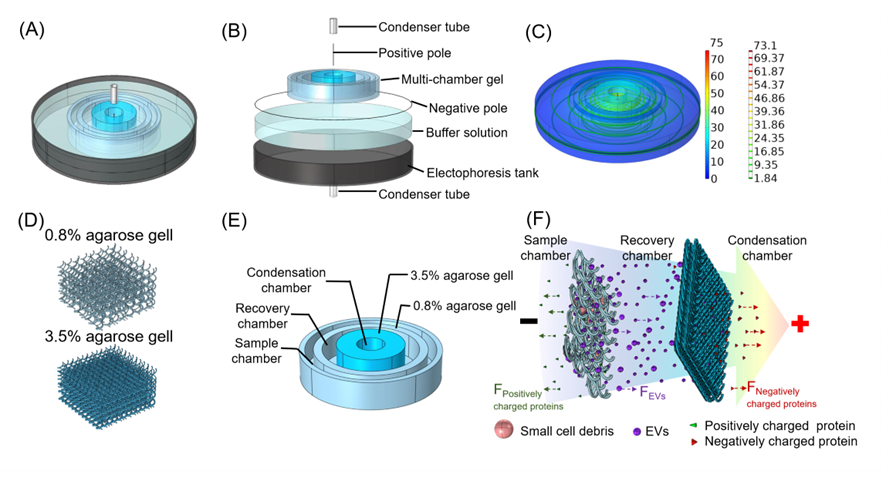
TOC图(来源:Analytical Chemistry)在圆环形非均匀电场中,电场强度随半径减小呈现指数型增加,根据电场特征依次区分为迁移区、加速区、浓缩区。通过在迁移区和加速区依次构建0.8%及3.5%浓度琼脂糖凝胶从而形成梯度孔径分离空间,在靶型多腔电泳装置由外环向中心依次形成样品室、回收室和浓缩室。在梯度非均匀电场驱动下,基于小细胞碎片、细胞外囊泡、蛋白质的尺寸和电荷比差异依次在样品室、回收室和浓缩室中保留并实现分离。在梯度连续圆环非均匀电场中由于加速区电场指数性增加的特征显著加速了分离过程,有利于样品连续注射实现EVs的快速高通量制备(图1)。
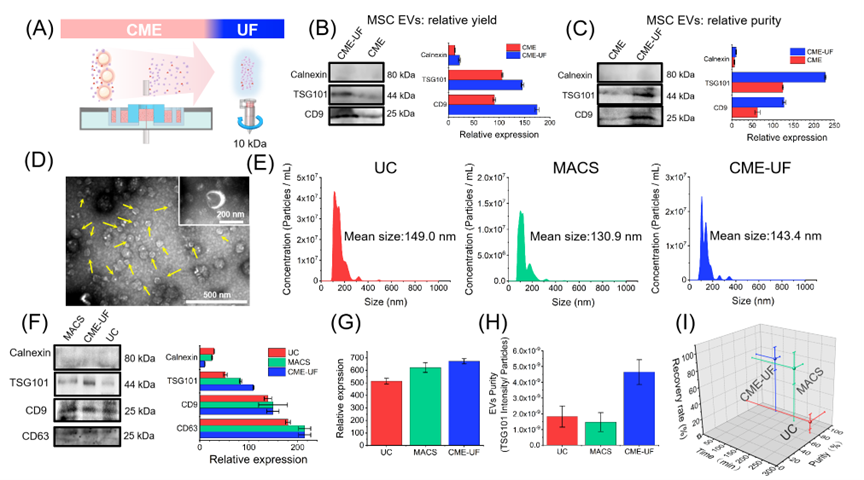
图1. CME装置设计及小细胞碎片、EVs和蛋白质的分离机理进一步利用超滤法(ultrafiltration,UF)联合CME叠加效应实现对CME回收室中EVs纯度和产量的提升。将CME-UF制备的EVs与超高速离心法(Ultracentrifugation, UC)和免疫磁珠法(Magnetic-Activated Cell Sorting, MACS)进行方法对比,结果表明CME-UF制备的EVs形态完整,使纯度水平比UC高3.15倍。 通过施加的连续梯度电场有利于快速连续分离,实现了在36 mL的细胞上清液中制备3.55 × 1010个/mL EVs,回收率接近87.65±9.03%。因此,CME-UF可以实现短时间内实现高纯度、高产量制备细胞外囊泡(图2)。
图2. CME联用UF高纯度高产量制备EVs及与UC和MACS方法对比利用传统UC方法和CME-UF方法分别制备脐带间充质干细胞的细胞外囊泡(UCMSC EVs),并对肝癌细胞摄取UCMSC EVs效率进行评估。结果显示CME-UF制备的脐带间充质干细胞细胞外囊泡的完整性和生物活性较好,肝癌细胞的摄取效率高达80.7%。而传统UC方法制备的UCMSC EVs其肝癌细胞摄取效率仅为16.1%,这是由于传统的UC方法纯度较低难以去除蛋白质等杂质可能会影响受体细胞对EVs的识别(图3)。综上,这项工作提出的靶型多腔电泳为细胞外囊泡的分离和制备提供了新方法,为后续生物学研究提供新平台。

图3. UC 和CME-UF方法制备UCMSC EVs的细胞摄取效率评价参考文献:Simultaneous Isolation and Preparation of Extracellular Vesicles by Circular Multicavity Electrophoresis. Analytical Chemistry 2025. DOI: 10.1021/acs.analchem.4c04560.