心力衰竭(HF)是全球范围内导致死亡的主要原因之一。细胞外囊泡,包括小型细胞外囊泡或外泌体及其分子货物,已知在多种心脏疾病中调节细胞间通讯。然而,在心力衰竭模型中系统性抑制细胞外囊泡生成的作用尚未被充分记录,其机制仍不清楚。Raj Kishore研究组在Circulation Research杂志发表文章,报道了Tipifarnib通过抑制外泌体生成和释放,以及调控miR 331-5p与HOXC8轴,能够有效减轻压力超负荷诱导的心力衰竭和纤维化,为心力衰竭的治疗提供了新的潜在策略。
根据《2023年世界心脏报告》,心血管疾病(CVDs)是主要的致命疾病,占全球死亡率的33%。临床证据表明,由各种病因导致的心力衰竭(HF)普遍存在,包括肥厚型心肌病、缺血性心脏病、中风和高血压,这些病因共同构成了全球85%的心血管疾病负担。探索调控心脏重塑的分子机制一直是一项巨大的挑战。
近年来,细胞外囊泡(EVs),尤其是小型细胞外囊泡(sEVs,亦称外泌体),作为心血管疾病的重要旁分泌调节因子受到关注。外泌体是直径30至200纳米的脂双层膜囊泡,携带生物活性物质(如蛋白质、核酸、miRNA、代谢物等),由其起源细胞分泌后被同一组织或远距离器官的受体细胞内化。外泌体主要通过自分泌或旁分泌信号影响受体细胞的命运,响应特定供体细胞外泌体中的货物内容。
尽管此前的研究已证明外泌体生成与分泌在受损心脏组织中具有重要作用,并能激活多种外泌体下游的分子机制,但在心脏损伤和心力衰竭模型中尝试系统性抑制外泌体生成的研究仍较为有限。尽管迄今为止已发现许多外泌体抑制剂,但遗憾的是,大多数研究主要集中于使用GW4869化合物(通过靶向nSMase2,亦即中性鞘磷脂酶2)作为外泌体抑制剂应用于心血管疾病模型。最近的研究表明,tipifarnib在癌症中的外泌体抑制作用表现出前景。该药物最初被开发为一种法尼基转移酶抑制剂,用于治疗各种实体瘤癌症,特别是HRAS突变的头颈癌。通过干扰Harvey鼠肉瘤病毒癌基因同源物(HRAS)的法尼基化,tipifarnib将其滞留在细胞质中,从而阻止其活性。然而,一些研究未能检测到tipifarnib对Ras的抑制作用。
Tipifarnib靶向三种关键酶:Alix(ALG-2相互作用蛋白X)、nSMase2和Rab27a(Ras相关结合蛋白27a),这些酶分别参与外泌体的生成、分泌和货物分选。然而,其在心脏损伤和心力衰竭模型中的潜在作用尚未被测试。
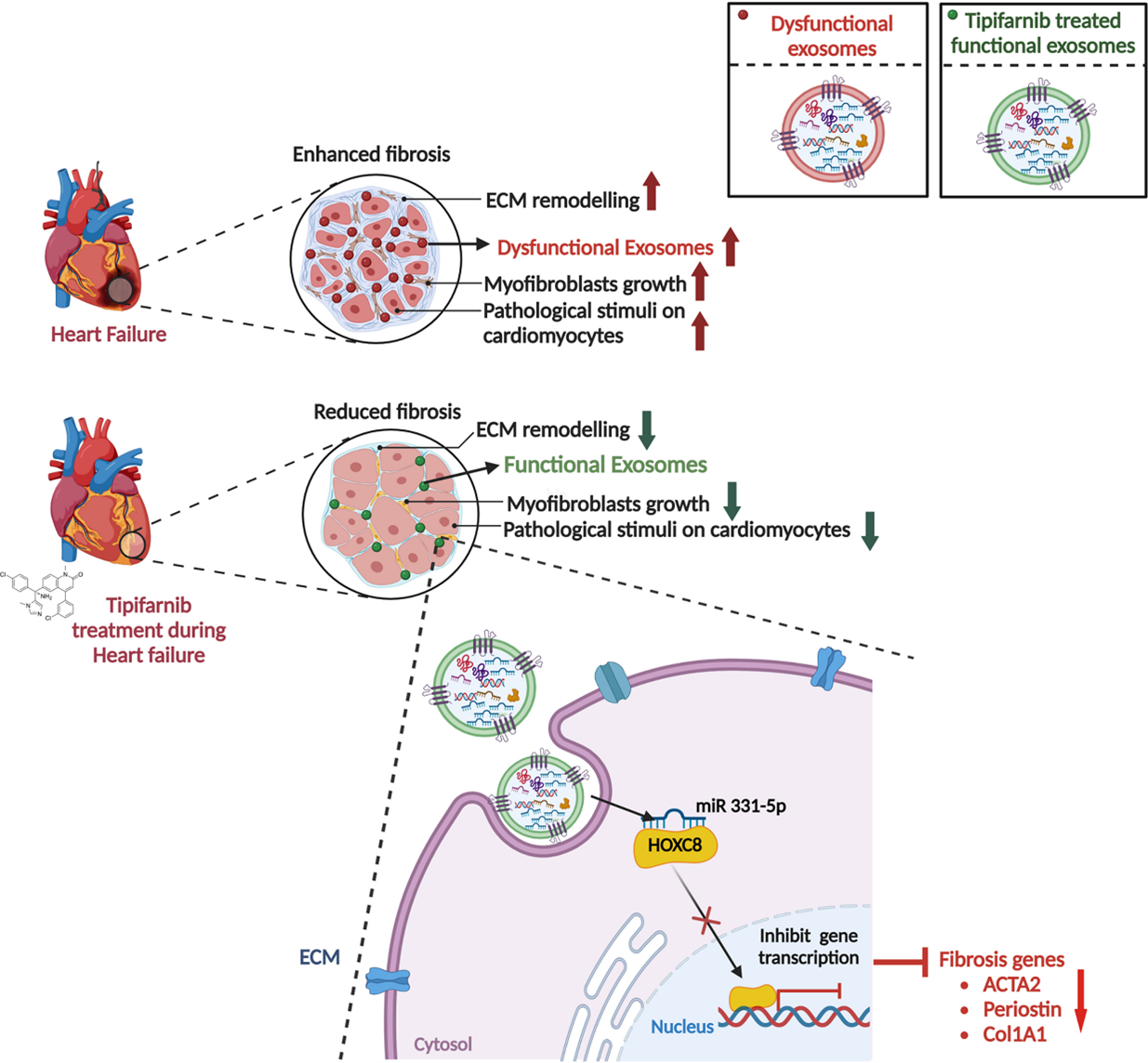
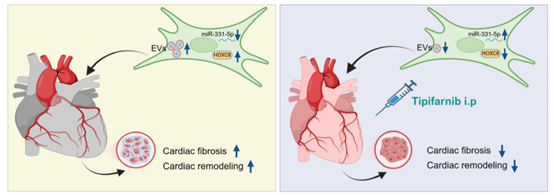
因此,这是首次探索tipifarnib作为外泌体生成抑制剂在TAC(主动脉缩窄)压力超负荷小鼠模型中减少系统性外泌体分泌的潜力。该研究表明,tipifarnib不仅显著减少了TAC诱导的循环外泌体升高,更重要的是,这种干预显著保护了TAC诱导的心脏肥大、左心室(LV)功能障碍和纤维化。此外,首次提供了外泌体miR-331-5p与HOXC8(同源框C8)轴在心脏成纤维细胞(CF)激活和纤维化中的正相关性证据。综上所述,该研究加深了对循环EVs/外泌体在心脏重塑中的理解,并为tipifarnib作为心力衰竭潜在治疗策略提供了临床前证据。
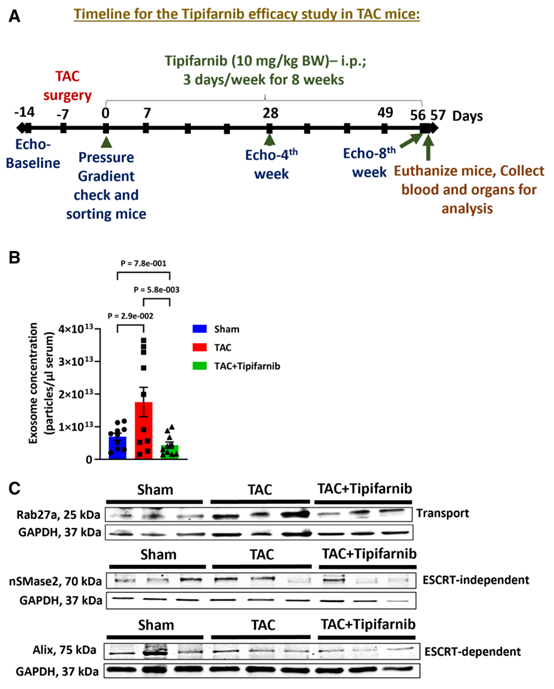
Tipifarnib在减少TAC小鼠外泌体生成和分泌方面具有显著效果
方法:
该报道研究了循环外泌体在小鼠主动脉缩窄(TAC)心力衰竭模型中的心脏功能障碍和重塑过程中的作用。重要的是,该研究评估了tipifarnib的疗效,这是一种新近发现的外泌体生成抑制剂,靶向参与外泌体生成的关键蛋白(Rab27a [Ras相关结合蛋白27a]、nSMase2 [中性鞘磷脂酶2] 和 Alix [ALG-2相互作用蛋白X]),并将其用于该心力衰竭小鼠模型。本研究中,接受TAC手术的10周龄雄性小鼠被随机分配到有或无tipifarnib治疗(10 mg/kg,每周3次)组并监测8周,同时通过超声心动图、组织学及生物化学研究进行了全面评估。
结果:
TAC显著提高了循环血浆外泌体水平,并显著加重了心脏左心室功能障碍、心脏肥大和纤维化。此外,将TAC小鼠血浆外泌体注射到未接受TAC的未受损小鼠体内,会引发左心室功能障碍和心肌细胞肥大。相反,TAC小鼠接受tipifarnib治疗后,循环外泌体水平恢复至基线水平,并显著改善了左心室功能、肥大和纤维化。Tipifarnib治疗还显著改变了TAC后循环外泌体的miRNA表达谱,其中miR 331-5p在TAC循环外泌体和TAC心脏组织中均显著下调。从机制上看,miR 331-5p通过靶向HOXC8(一种纤维化的关键调节因子)抑制成纤维细胞向肌成纤维细胞的转化,在这一过程中起到了重要作用。TAC小鼠接受tipifarnib治疗后,miR 331-5p的表达上调,作为HOXC8介导纤维化机制的有力抑制因子发挥作用。
结论:
该研究强调了外泌体在压力超负荷引起的心力衰竭和纤维化中的病理作用。通过tipifarnib介导的外泌体生成和货物分选的抑制,可作为预防心力衰竭中逐渐进展性心脏重塑的可行策略。
新颖性与意义
已知内容:
- 心血管疾病,尤其是心力衰竭(HF),会加速循环系统中小型细胞外囊泡(EVs)的分泌,导致蛋白质、小型非编码RNA(如miRNAs、lncRNA)和细胞因子在供体细胞与受体细胞之间传播。这些囊泡的货物有可能作为疾病的生物标志物。
- 当前的治疗策略主要集中于抑制纤维化、免疫调节和心肌细胞增殖。然而,针对外泌体生成、货物分选、释放及摄取的机制可能为解决心力衰竭期间的不良细胞间通信提供一种新颖的途径。
- 化合物GW4869已被广泛用作外泌体抑制剂,但尚未作为治疗心血管疾病的候选药物进行研究。新的候选药物已被用于针对小型细胞外囊泡的有效性测试,尤其是在癌症中。Tipifarnib最初被开发为一种法尼基转移酶抑制剂,用于治疗实体瘤,通过抑制法尼基转移酶底物Harvey鼠肉瘤病毒癌基因同源物的功能。
本文贡献的新信息:
- 该研究提供了证据表明外泌体分泌及其内容物在心力衰竭的发病机制中具有重要作用,减少循环系统中外泌体生成和分泌可以对抗这种病理过程。
- 该研究首次提供了令人鼓舞的证据,证明tipifarnib在压力超负荷心力衰竭模型中能够有效抑制外泌体生成及其在全身循环中的释放,这可能在心力衰竭期间的心脏重塑中发挥作用。
- Tipifarnib治疗可以抑制外泌体生成相关蛋白Rab27a(Ras相关结合蛋白27a)、nSMase2(中性鞘磷脂酶2)和Alix(ALG-2相互作用蛋白X),这些蛋白也参与外泌体货物分选。该机制促使miRNAs的主要重组,阻止了心力衰竭中的纤维化进展。
- 在多项针对实体瘤的临床试验中,有多项研究支持tipifarnib的临床安全性和有效性。因此,将此药物重新用作治疗心力衰竭的药物具有潜在可能性。
文献中不断涌现的证据表明,细胞外囊泡(包括小型细胞外囊泡,亦称外泌体)在心脏稳态和疾病中的细胞间通信中发挥重要作用。在多种心血管疾病中,包括心肌梗死和心力衰竭,循环细胞外囊泡数量的增加已有文献记录。然而,细胞外囊泡是否在心力衰竭的进展中发挥病理作用,或系统性抑制细胞外囊泡分泌是否能够保护心力衰竭,目前尚未明确。
该研究提供了证据表明,Tipifarnib(一种法尼基转移酶抑制剂)能够靶向多个参与细胞外囊泡生成及货物分选的基因,显著减少循环细胞外囊泡,并改变其微RNA内容,包括miR 331-5p。通过tipifarnib减少细胞外囊泡并改变细胞外囊泡中的miR 331-5p,可以在压力超负荷诱导的心力衰竭小鼠模型中保护心力衰竭。研究结果支持一种新颖机制,表明miR 331-5p通过靶向HOXC8(一种纤维化的关键调控因子)抑制成纤维细胞向肌成纤维细胞的转化。
参考文献:
Mallaredy V, Roy R, Cheng Z, Thej C, Benedict C, Truongcao M, Joladarashi D, Magadum A, Ibetti J, Cimini M, Gonzalez C, Garikipati VNS, Koch WJ, Kishore R. Tipifarnib Reduces Extracellular Vesicles and Protects From Heart Failure. Circ Res. 2024 Jul 5;135(2):280-297. doi: 10.1161/CIRCRESAHA.123.324110. Epub 2024 Jun 7. PMID: 38847080; PMCID: PMC11223950.
Yue Z, Cheng K. "Tip" the Scale of Cardiac Repair via Reducing Pathological Extracellular Vesicles. Circ Res. 2024 Jul 5;135(2):298-300. doi: 10.1161/CIRCRESAHA.124.324955. Epub 2024 Jul 4. PMID: 38963869; PMCID: PMC11285627.