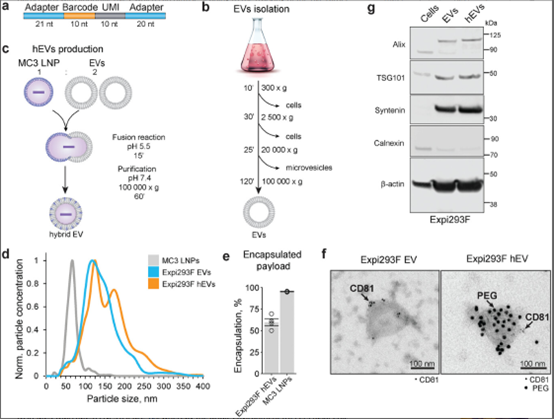
靶向药物递送作为现代医学领域中的一个重要研究方向,面临着持续的挑战。近年来的研究突显了细胞外囊泡(EVs)作为药物递送载体的潜力,因其自然存在于血液和各种组织中,并具备承载多种治疗分子的能力。然而,EVs的生物分布特性及其对特定组织的趋向性仍然是一个尚未被系统深入研究的问题。来自瑞典阿斯利康公司的研究人员提出了一种创新的多重方法,在同一实验中追踪了不同细胞来源的EVs。该策略通过将来自不同细胞系的EVs与携带DNA条形码的脂质纳米颗粒(LNPs)相结合,生成杂交EV(hEVs)。在小鼠模型中进行生物分布分析中发现,HAP1细胞来源的hEVs具有显著的肺部趋向性。本研究展示了该方法能够高效地获取大量的EV生物分布数据,并为进一步绘制组织趋向图以及识别潜在的组织特异性药物递送载体提供了有力工具。相关内容以“Barcoded Hybrids of Extracellular Vesicles and Lipid Nanoparticles for Multiplexed Analysis of Tissue Distribution”为题在线发表于1月16日的国际知名综合性学术期刊Advanced Science杂志上。
靶向药物递送系统旨在通过将药物定向输送至病灶部位,从而提高疗效并减少药物的使用量,进而降低不良副作用的发生。尽管靶向递送具有显著优势,但其研发依然面临诸多挑战,特别是如何针对不同组织或细胞进行特异性递送,同时避免对健康组织的影响。此外,生物屏障的存在(如血脑屏障)、免疫系统的清除作用、药物的局部释放控制需求以及确保药物生物相容性和安全性的要求等因素,都使得靶向药物递送的实现更加复杂。在靶向药物递送系统的研究中,细胞外囊泡(EVs)因其天然来源、良好的生物相容性和能够运输多种亲水性和疏水性分子而日益受到关注。此外,EVs具有较强的组织靶向性,使其成为潜在的理想药物递送载体。然而,EVs的组织趋向性和其来源细胞对生物分布的影响仍未完全阐明,这一问题的研究面临较大困难,主要源于EVs的复杂性、小尺寸以及在体内循环过程中的短半衰期。目前,尽管有研究尝试通过光学成像、核医学成像和磁共振成像等方法进行EV的体内追踪,但仍存在诸多局限,尤其是灵敏度和准确性不足的问题,难以提供精确的全身生物分布数据。另外,荧光成像技术可能受到伪影的干扰,特别是脂溶性染料的扩散,导致标记物的追踪不准确。同样,放射性同位素标记的方法(如PET、SPECT成像)虽然可以用于EV追踪,但其对设备和专业知识的要求较高。更重要的是,目前尚无方法能够在同一实验动物中同时研究多种来源EV的生物分布。因此,开发一种能够同时追踪多种EV并进行体内分析的友好方法,对于该领域的研究具有重要的意义。为了克服这些挑战,本研究开发了一种创新的多重策略,旨在同时监测和量化不同细胞来源的EVs在体内的生物分布。研究团队利用16种不同细胞系来源的EVs,通过与携带单链DNA条形码的脂质纳米颗粒(LNPs)进行受控融合,构建了具有独特条形码的杂交EV颗粒(hEV)库。这些hEVs被注入小鼠体内进行多重生物分布分析,结果表明,来自HAP1细胞系的hEVs表现出强烈的肺部趋向性,表明这些hEVs有望作为靶向药物递送系统,直接将药物输送至肺组织。进一步的实验验证了,HAP1来源的hEV能够有效递送Cre mRNA到小鼠肺部,证明了其在肺部的功能性递送能力。总体而言,条形码hEV技术为多种来源的EV生物分布研究提供了快速且高效的方法,具有提升EV研究通量与范围的潜力,并能在减少实验动物数量的同时,实现更精确的靶向递送研究。参考文献:Barcoded Hybrids of Extracellular Vesicles and Lipid Nanoparticles for Multiplexed Analysis of Tissue Distribution. Adv Sci (Weinh). 2025 Jan 16: e2407850.