细胞外囊泡(EV)是遗传物质和蛋白质递送的高级平台,尤其是通过所谓的内源性装载方法进行装载时。来自西班牙巴斯克大学的研究人员通过基因工程改造的C2C12成肌细胞中(表达模型分子促红细胞生成素和绿色荧光蛋白)获得的大型EV(lEV)和小型EV(sEV)之间的差异,比较了这些EV亚型在蛋白质和核酸装载、细胞间载物转移能力以及体外和体内功能效应方面的差异。这是首次深入探究内源性装载的lEV与sEV差异的研究,为优化生物制剂疗法开辟新途径,提示选择合适的EV亚型对提升EV递送策略疗效具有关键作用。相关内容以“Differential protein and mRNA cargo loading into engineered large and small extracellular vesicles reveals differences in in vitro and in vivo assays”为题在线发表于1月31日的国际知名纳米科学学术期刊Journal of Controlled Release杂志上。
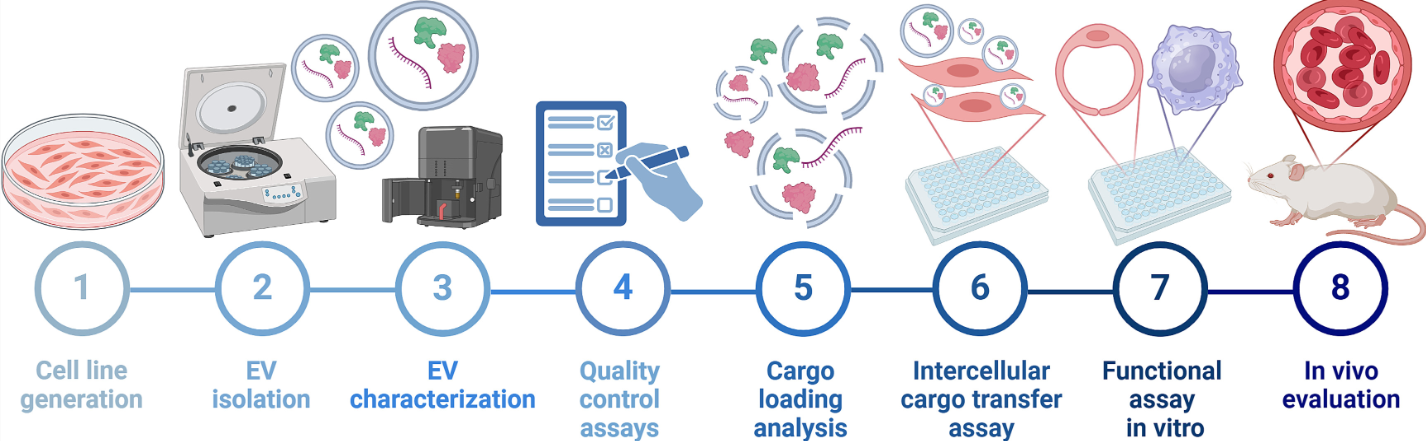
基于生物制剂的治疗手段(特别是涉及蛋白质和核酸的药物)在治疗多种疾病方面展现出巨大潜力。然而这类药物常面临稳定性差、免疫原性强和脱靶效应等重大挑战,严重制约了其临床疗效和安全性。为解决这些局限,传统基于纳米颗粒的递送系统(如脂质体)已得到广泛研究。近年来,随着纳米医学的发展,细胞外囊泡(EV)因其独特的优势(包括优异的生物相容性、天然靶向能力和更高的安全性)被视为极具前景的替代载体。EV是从细胞膜衍生的纳米级颗粒,通过运输蛋白质、脂质和遗传物质在细胞间通讯中发挥关键作用,这种天然的载物传输能力使其成为高效的药物递送工具。EV可通过外源性或内源性方法装载治疗分子:外源性方法是在分离EV后进行药物装载;内源性方法则通过基因工程改造母细胞使其过表达治疗性载物,在EV生物发生过程中完成载物整合。虽然外源性方法应用广泛,但内源性方法因能装载更大更复杂的生物分子且保持EV膜完整性而备受关注。这种基于基因工程的策略不仅能有效装载治疗分子,还能将生物药物生产与EV分离流程整合为更高效的一体化工序,目前已在EV基因载物领域广泛应用。近年来,一些研究开始探索其在蛋白质递送中的应用潜力。尽管EV疗法备受关注,但对于不同EV亚型(特别是大型EV(lEV)和小型EV(sEV))在内源性装载方法中载物能力的差异仍缺乏深入研究。实际上,由于不同EV亚型遵循不同的生物发生途径,其载物组成和治疗潜力可能差异显著。此外,虽然sEV已被广泛研究,但lEV在药物递送中的作用仍属未知领域。填补这些知识空白对优化EV治疗应用至关重要,因为掌握各亚型特性可显著提升EV疗法的疗效。这项研究旨在探索内源性装载方法中不同生物分子在EV亚型中的分布差异,评估其药物递送潜力。研究人员通过基因工程改造C2C12成肌细胞,使其过表达促红细胞生成素(EPO)和TGL蛋白(构建EPO-TGL-C2C12细胞系)。EPO是分泌型蛋白,除促进红细胞生成外,还具有抗炎、抗氧化和促血管生成等非造血作用,在多种疾病治疗中潜力显著,其体内治疗效果可通过血细胞比容水平变化便捷监测。TGL是包含绿色荧光蛋白(GFP)和荧光素酶的嵌合非分泌型胞质蛋白,可用于成像和追踪细胞内过程。该研究系统比较了装载EPO-TGL的lEV和sEV(分别命名为lEVEPO-TGL和sEVEPO-TGL)的特性与功能差异。依据《细胞外囊泡研究最低信息标准2023版》,研究人员分析了EV的产量、尺寸、形态和标志物表达,并建立了严格的质量控制体系:通过检测可溶性蛋白污染程度验证EV纯度,通过生物分子装载实验确认货物有效性;定量分析lEVEPO-TGL和sEVEPO-TGL的蛋白质与mRNA载量,比较其细胞间转移能力;测试EV向巨噬细胞、人脐静脉内皮细胞(HUVECs)等细胞系递送EPO的效果,评估其体外功能效应;最后在体内评估EV递送EPO的治疗潜力。这些分析从货物装载、递送能力和生物学效应等多维度比较了EV亚型的差异。结果表明,lEV比sEV表现出更高的蛋白质和mRNA载物含量,这也转化为更强的细胞间货物转移能力,即使按照sEV和lEV的分泌比例(10:1)进行剂量调整时也是如此。研究人员发现,尽管受体细胞成功内化了两种EV亚型,但与sEV处理的细胞相比,lEV处理的细胞显示出更强的细胞内荧光素酶信号和更高的EPO蛋白分泌。在功能效应方面,两种EV亚型在脂多糖激活的巨噬细胞中均表现出抗炎和抗氧化作用,并在人脐静脉内皮细胞中表现出促血管生成作用。最后,体内研究表明,皮下注射lEV比sEV导致更显著的血细胞比容水平和红细胞计数的增加。综上所述,这些发现表明,内源性装载的EV亚型之间的蛋白质和mRNA载物存在差异,并且这种载物差异导致了它们功能结果的不同。因此,选择EV亚型可能对优化基于EV的生物药物递送策略至关重要。参考文献:Differential protein and mRNA cargo loading into engineered large and small extracellular vesicles reveals differences in in vitro and in vivo assays. J Control Release. 2025 Jan 31;379:951-966.




