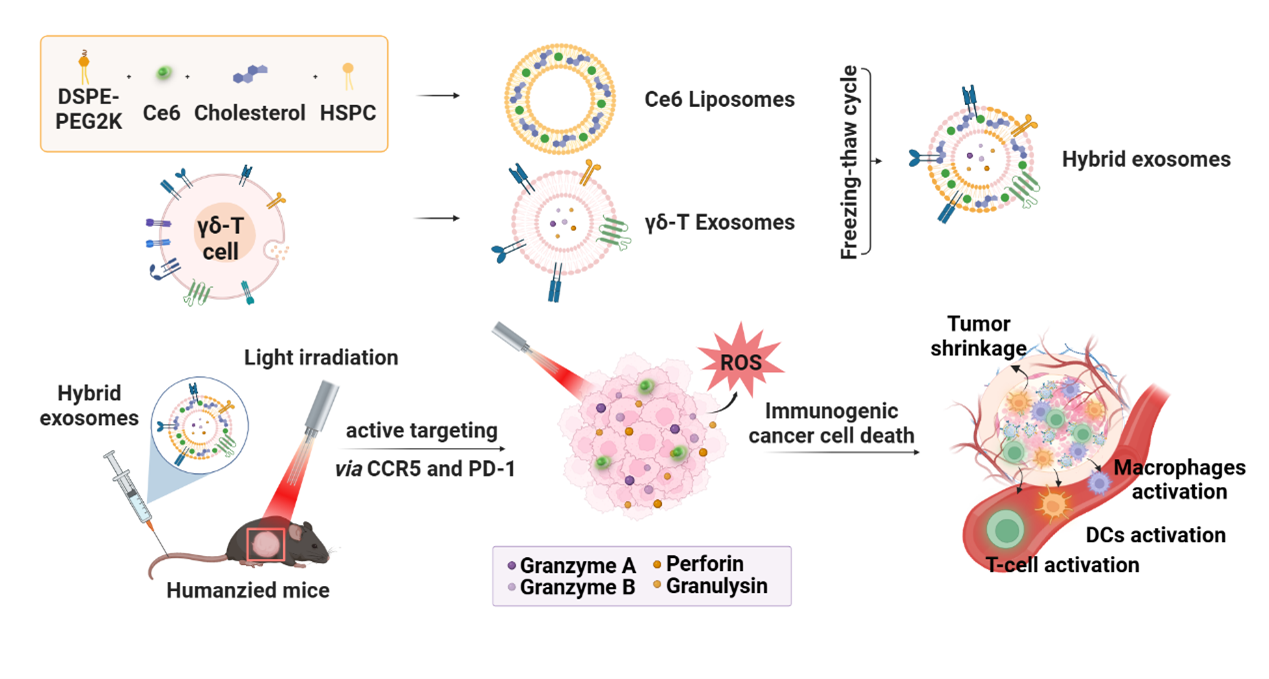
黑色素瘤(Melanoma)是最具侵袭性的皮肤癌类型之一,由于肿瘤发展进程快且转移率高,患者的中位生存期仅约为3至11个月。目前黑色素瘤的治疗手段主要局限于化疗和放疗。由于缺乏肿瘤靶向作用,并且只能在短时间内防止复发,患者的预后情况往往不够理想。因此,目前临床上仍缺乏能够有效靶向黑色素瘤的治疗手段。近期,香港大学医学院临床医学院儿童及青少年科学系涂文伟团队与药理及药剂学系汪卫平团队于ACS Nano杂志上共同发表了题为“Photosensitive hybrid γδ-T exosomes for targeted cancer photo-immunotherapy”的论文(Gao et al. 2025)。该设计通过融合γδ-T外泌体和载有Chlorin e6 (Ce6)的脂质体得到了光响应杂交γδ-T外泌体,实现了光控的肿瘤特异性杀伤反应与抗肿瘤免疫反应,为黑色素瘤的治疗提供了新的思路。香港大学医学院涂文伟教授与汪卫平教授为论文的共同通讯作者,高逸凡与刘金钊为论文的共同第一作者。
γδ-T外泌体(γδ-T exosomes)是一类来源于γδ-T细胞的细胞外囊泡,涂文伟教授团队在过去数年的研究成果揭示了γδ-T外泌体能够主动靶向EB病毒相关肿瘤细胞并实现肿瘤杀伤功能。同时,γδ-T外泌体兼有促抗肿瘤免疫反应的作用,可以有效诱导T细胞抗肿瘤免疫反应(Wang et al. 2020)。基于γδ-T外泌体的抗肿瘤功能,本文开发了协同了光动力疗法(Photodynamic therapy, PDT)的光敏γδ-T外泌体疗法用于治疗黑色素瘤。
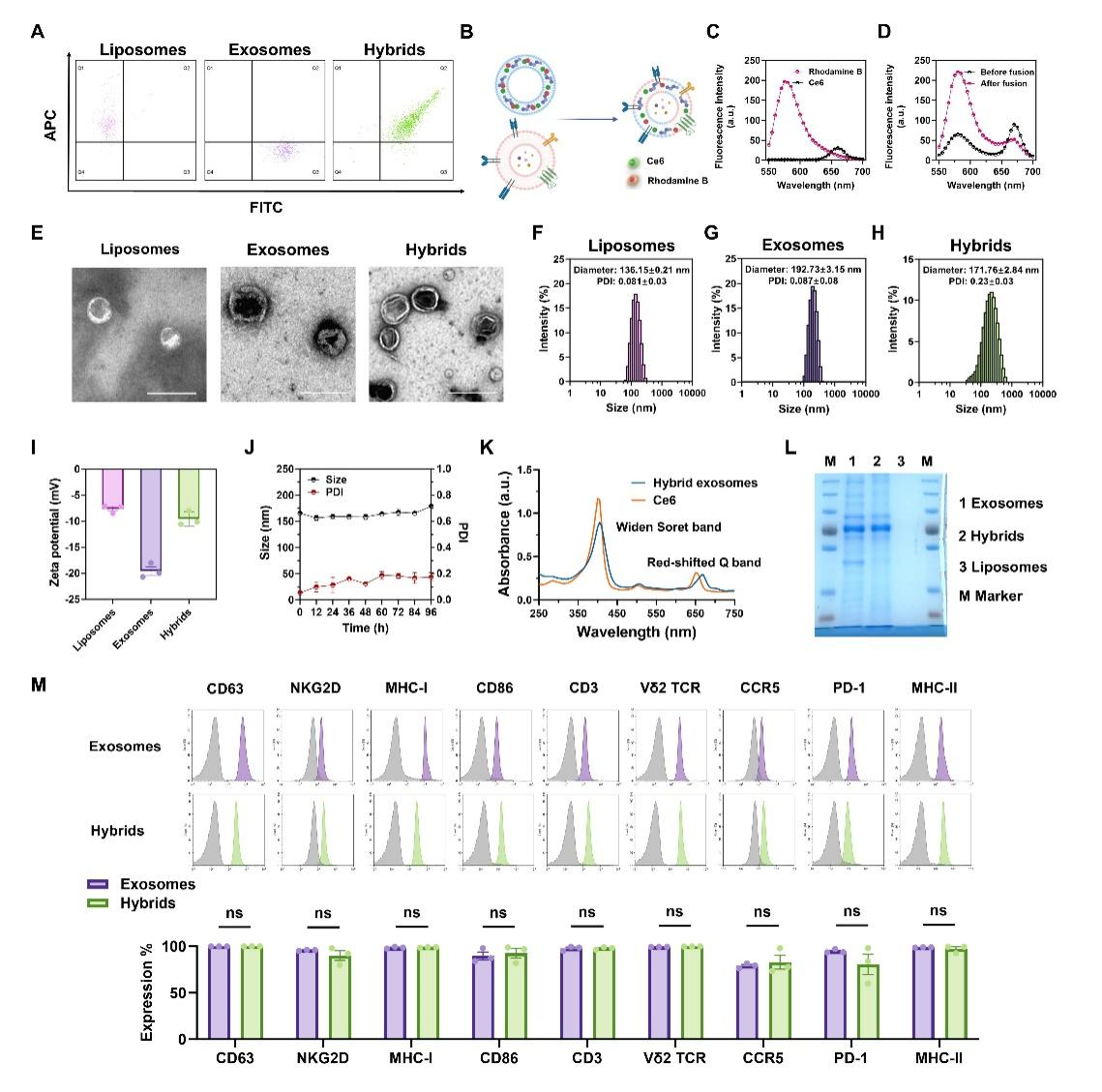
该研究首先通过膜融合的方式将γδ-T外泌体与载有Chlorin e6 (Ce6)的脂质体进行杂交产生了光响应杂交γδ-T外泌体,该杂交外泌体在兼有γδ-T外泌体的物理化学性质之外,还包载Ce6光敏剂用于光动力治疗(图一)。
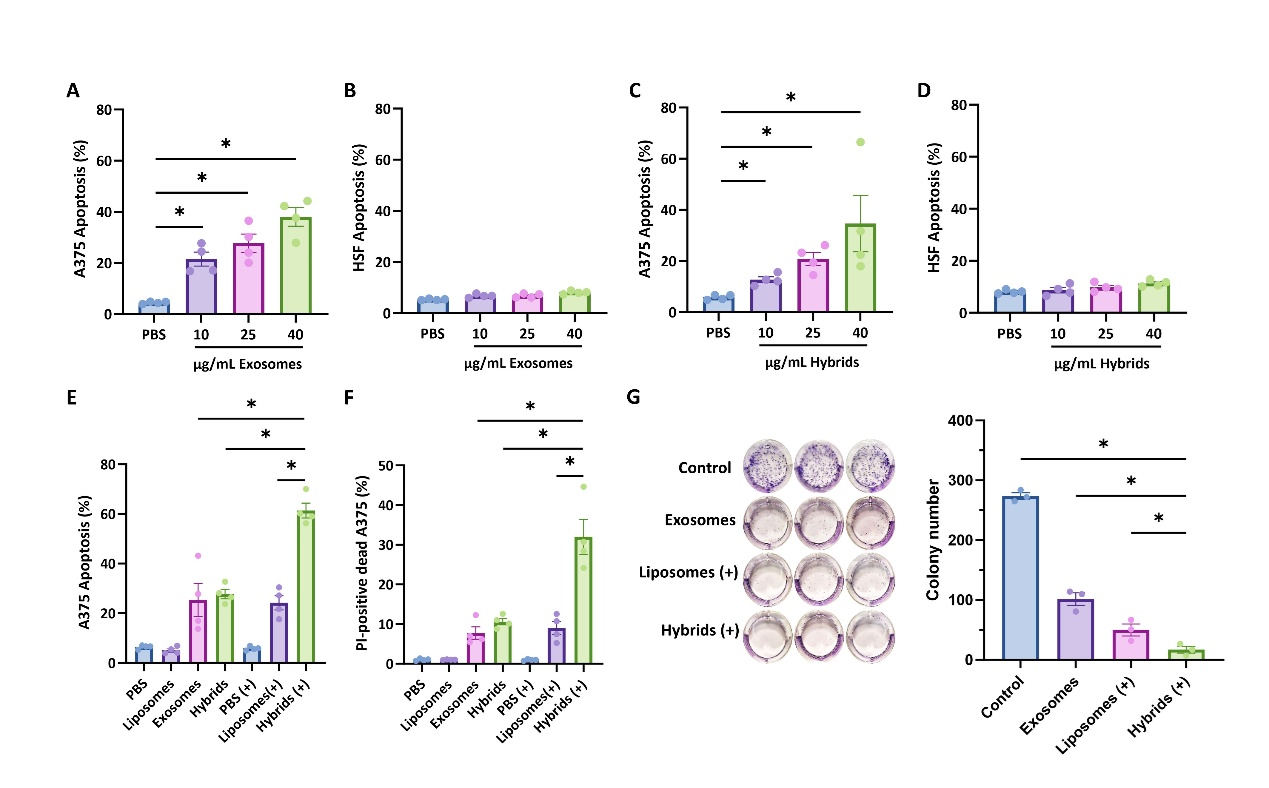
图一 光响应杂交γδ-T外泌体的性质表征体外数据表明,杂交γδ-T外泌体在无光照条件下仅对人黑色素细胞(A375)产生毒性,而对正常人皮肤纤维细胞(Human skin fibroblast, HSF)几乎不产生毒性,提示了该杂交外泌体的生物安全性。进一步的光照刺激增强了杂交γδ-T外泌体的肿瘤杀伤功能(图二)。
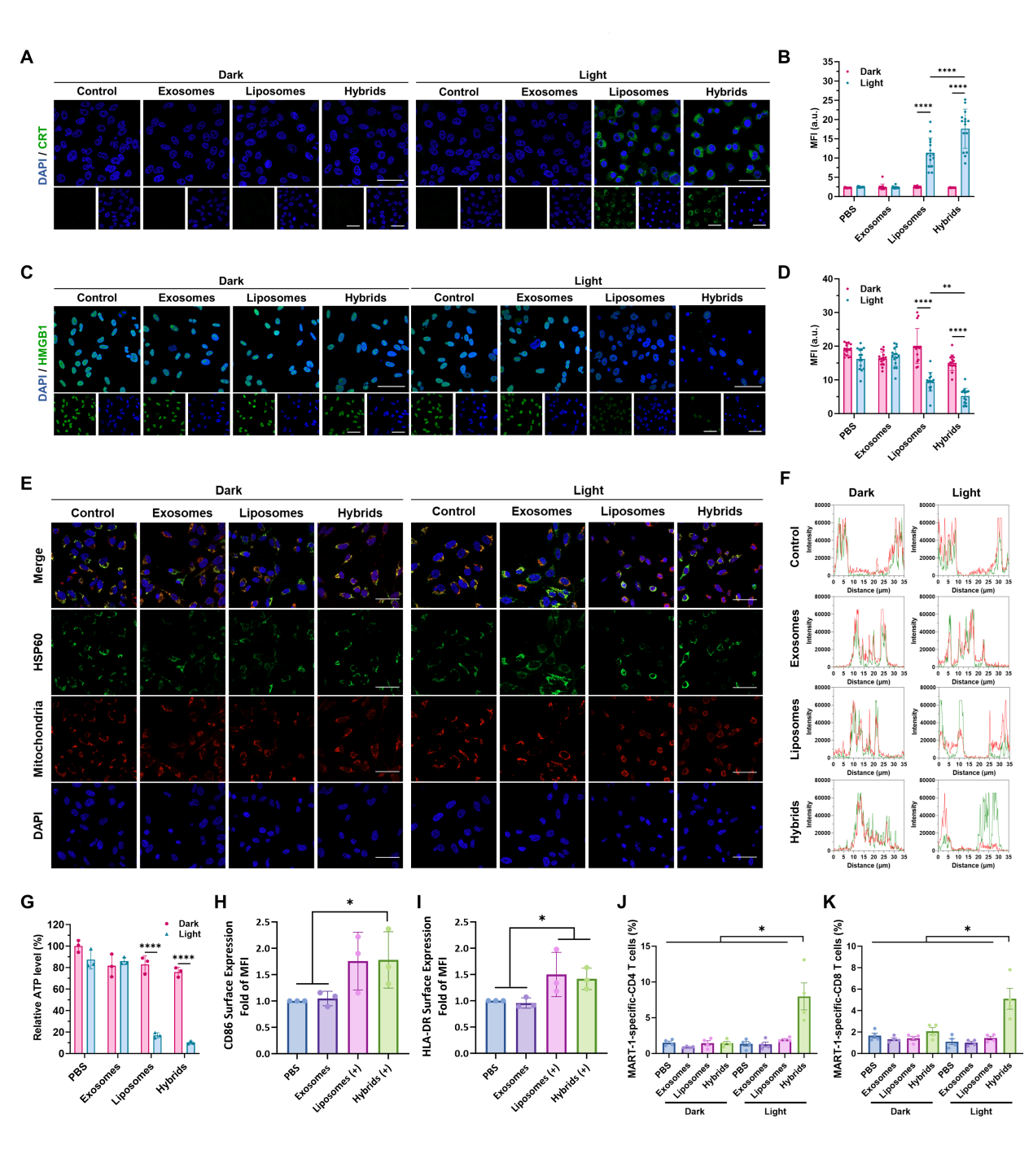
图二 光响应杂交γδ-T外泌体的肿瘤杀伤功能在PDT反应诱导下,杂交γδ-T外泌体处理的肿瘤细胞释放了包括CRT, HMGB1和ATP在内的一系列损伤相关的分子模式(damage associated molecular patterns, DAMPs)。免疫原性的细胞死亡(immunogenic cell death, ICD)刺激了包括巨噬细胞(macrophages)和树突状细胞(dendritic cells)的成熟与激活,进一步促进了黑色素瘤MART-1抗原特异性的T细胞反应(图三)。
图三 免疫原性的细胞死亡与抗肿瘤免疫反应为了进一步验证体外实验结果,作者建立了黑色素瘤的人源化小鼠模型探究杂交γδ-T外泌体的治疗效果和免疫反应(Tu and Zheng 2016)。结果显示,杂交γδ-T外泌体有效控制了肿瘤的生长,促进了人巨噬细胞与人树突状细胞的功能,并进一步诱导了T细胞的激活与肿瘤浸润(图四)。
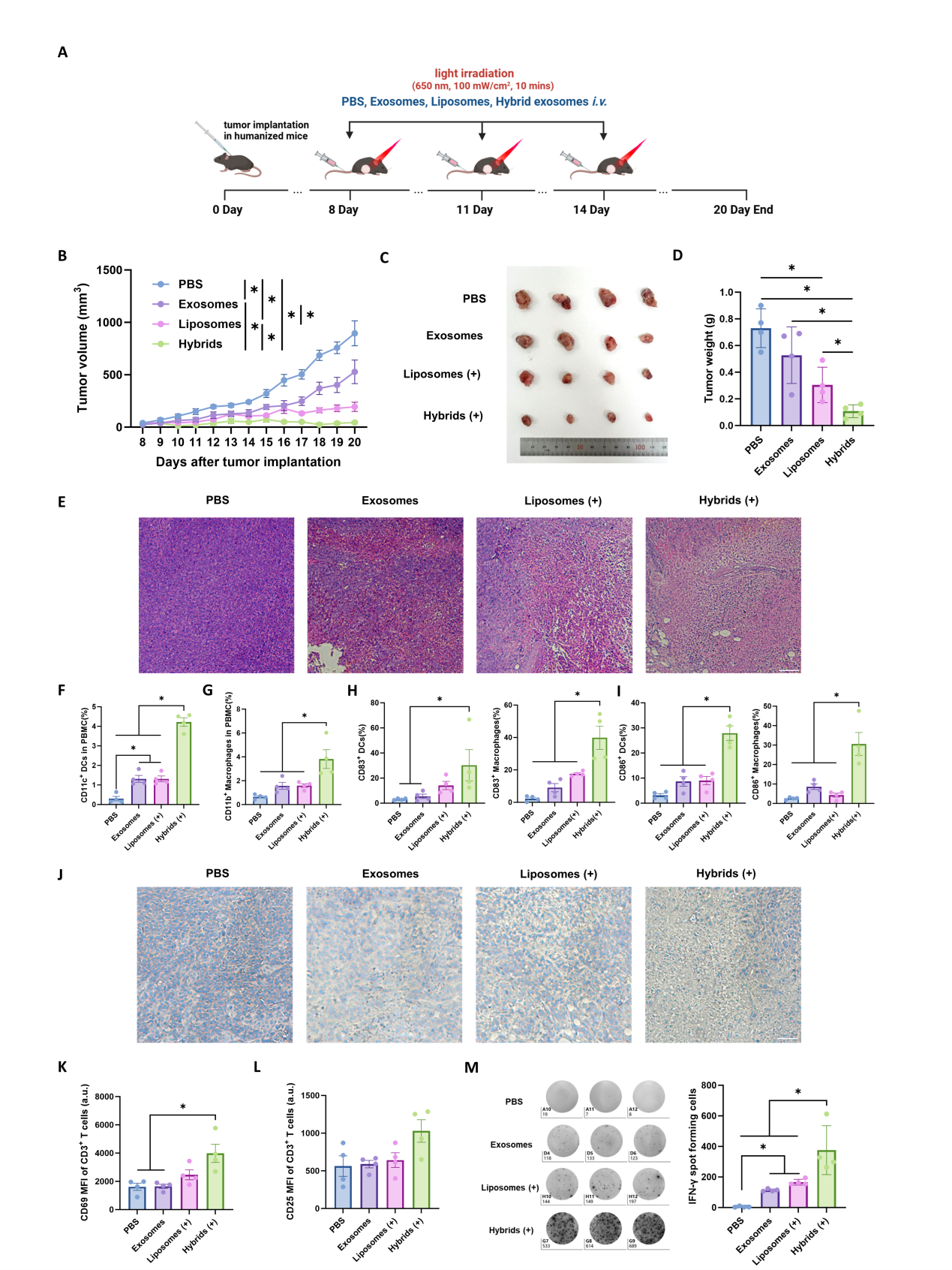
图四 杂交γδ-T外泌体在人源化荷瘤小鼠中的治疗作用综上所述,该研究提供了一种将γδ-T外泌体与PDT相结合进行光免疫治疗的有前景的策略,从而拓展了γδ-T外泌体治疗癌症患者的临床应用。参考文献:Photosensitive Hybrid γδ-T Exosomes for Targeted Cancer Photoimmunotherapy,Acs Nano 15.8SWJTU A++. 2025 Feb 4;19(4):4251-4268.doi:10.1021/acsnano.4c11024. Epub 2025 Jan 25.
外泌体资讯网 ACS Nano|香港大学医学院涂文伟课题组与汪卫平课题组:光响应杂交γδ-T细胞外泌体用于肿瘤靶向光敏免疫治疗