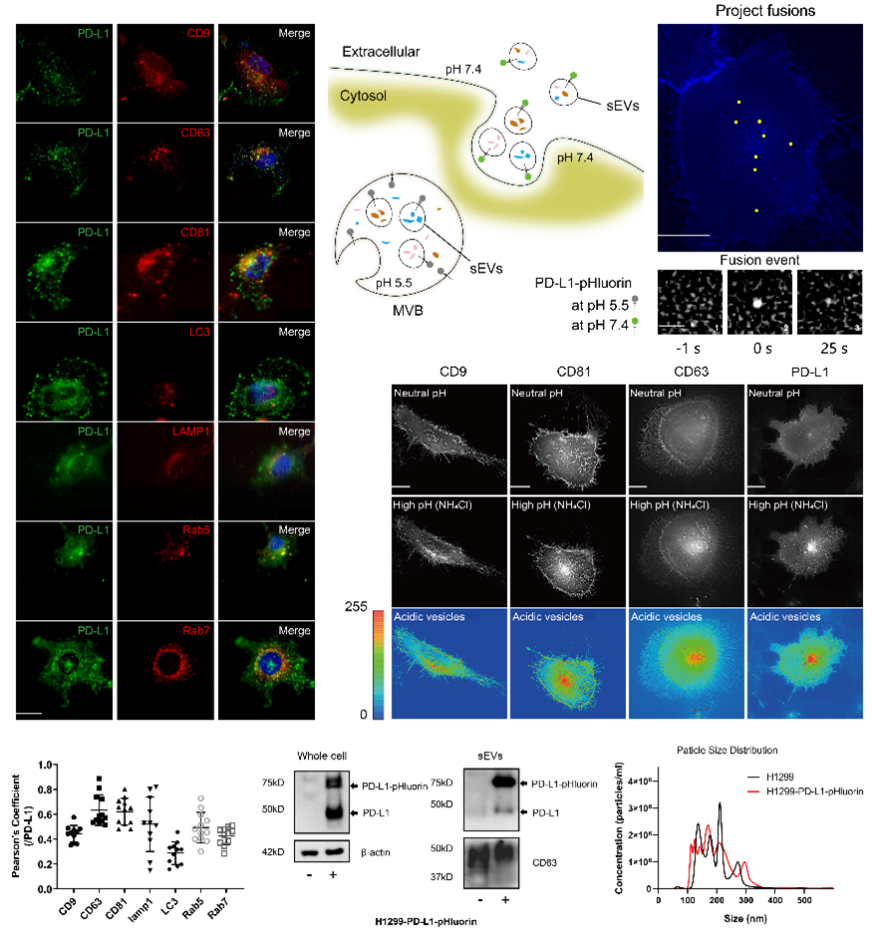
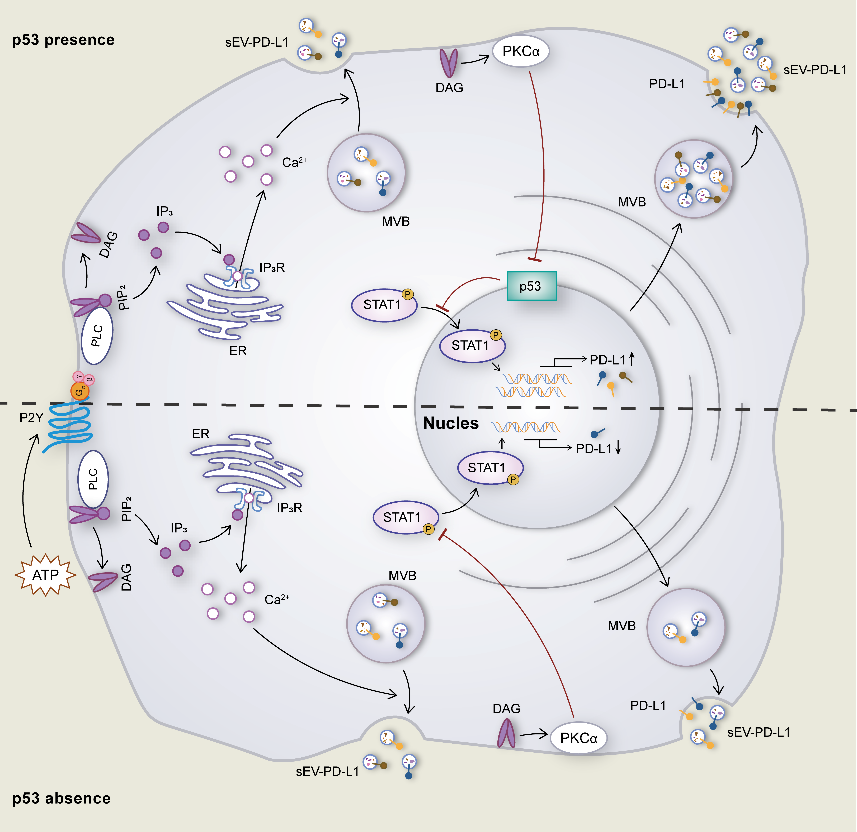
细胞外囊泡是一类由细胞释放的脂质双层结构,包含蛋白质、RNA和脂质等关键成分,它们在细胞间通讯和微环境调控方面中扮演重要角色。外泌体属于细胞外小囊泡(Small EVs,外泌体),因其拥有多种生物学功能而受到关注。研究发现在一些外泌体上含有免疫检查点分子PD-L1,称为PD-L1外泌体,它在肿瘤免疫方面起重要的调控作用。 近日,澳门科技大学于海杰团队在Cell Death & Disease期刊上在线发表题为“PKCα regulates the secretion of PDL1-carrying small extracellular vesicles in a p53-dependent manner”的论文(PMID: 39809736),该研究在之前钙离子通道影响PD-L1外泌体分泌的基础上,发现PD-L1外泌体的分泌受细胞内钙离子和钙依赖性蛋白PKCα信号通路的调控,并受p53蛋白的影响。张韧和廖威林为共同第一作者,于海杰副教授、马丽娟助理教授为论文通讯作者。
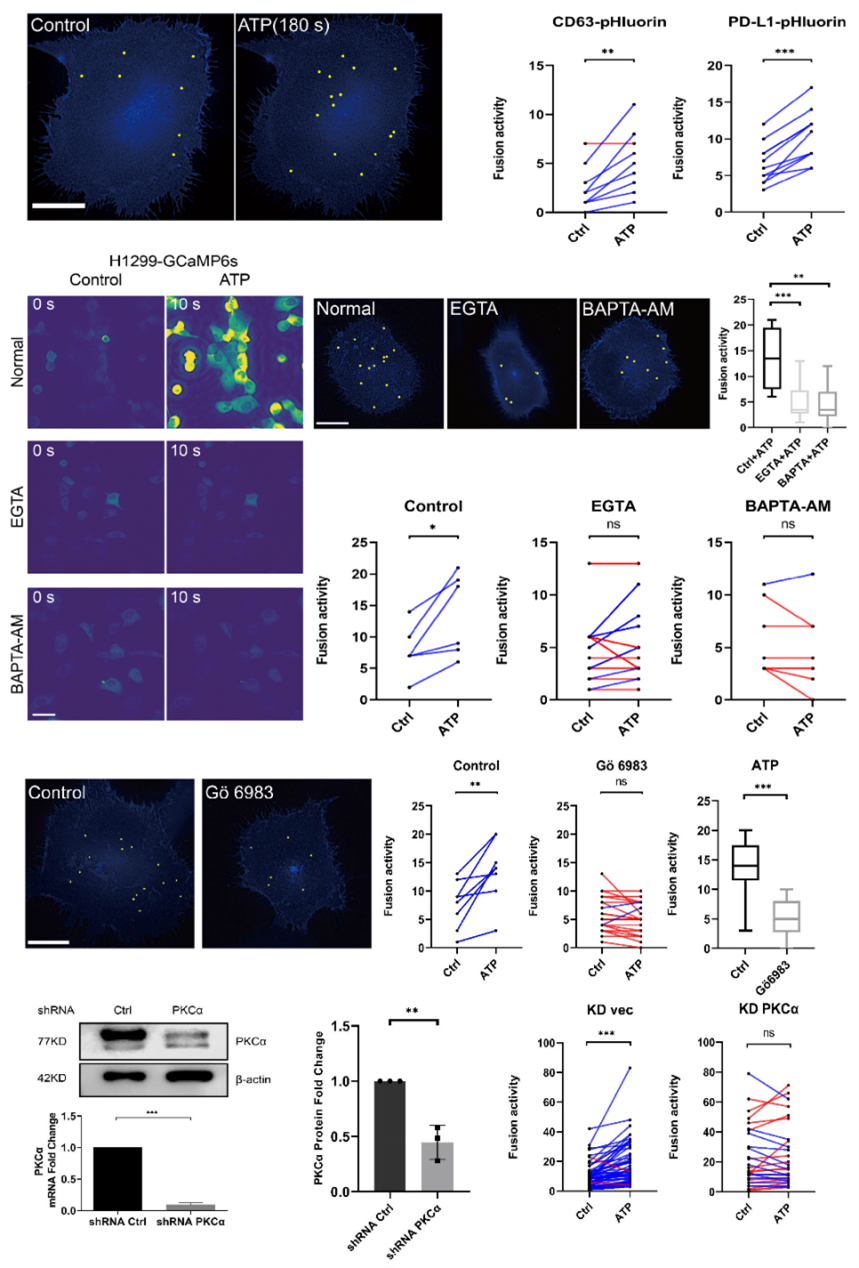
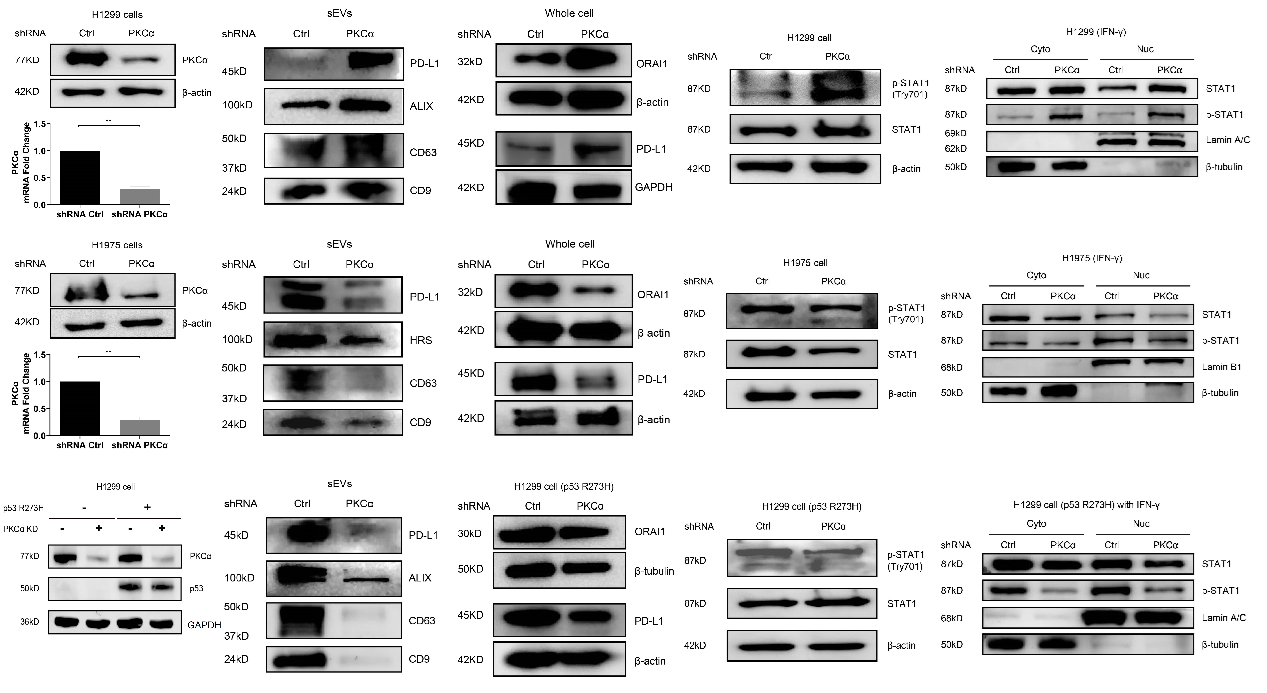
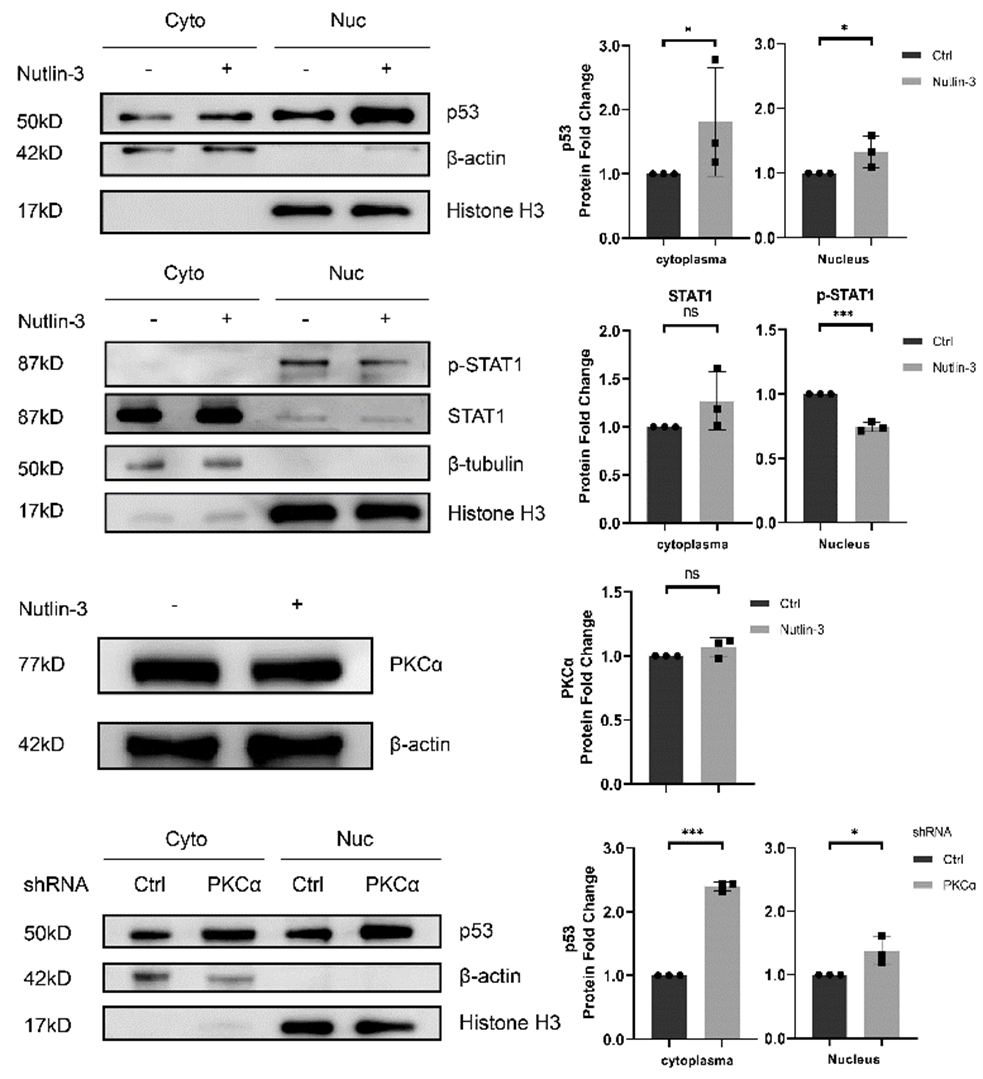
该研究发现PD-L1细胞内分布与外泌体marker高度重合,特别是CD63和CD81。通过构建pH敏感探针(pHluorin)的PD-L1质粒,观察到PD-L1多囊小泡(MVBs)与细胞膜融合。Western blot和NTA分析进一步证实这种PD-L1外泌体与其他外泌体的大小没有显著差异。PD-L1外泌体的分泌动力学显示其与他外泌体分泌相似,分泌过程中荧光强度的峰值也相似。图1 PD-L1 定位和多囊小泡与细胞膜融合动态可视化分析 钙离子和相关信号通路在PD-L1外泌体分泌中起关键作用。通过ATP刺激,引起细胞内钙离子水平升高,导致PD-L1外泌体释放增加。钙离子螯合剂和钙依赖性激酶PKC的抑制剂,可以使ATP诱导的PD-L1外泌体释放显著减少,表明钙离子和PKC在PD-L1外泌体释放中的重要性。并且,敲低PKCα同样引起ATP诱导的PD-L1外泌体释放显著减少。图2 钙离子和PKCα调节ATP引起的PD-L1外泌体分泌PKCα通过p53依赖的方式调节PD-L1。敲低缺失p53基因的H1299肺癌细胞的PKCα,PD-L1外泌体增加,而在含有p53 R273H突变的H1975肺癌细胞中,敲低PKCα却引起PD-L1外泌体降低。研究发现,H1299细胞的PKCα敲低增加了与PD-L1表达相关的转录因子STAT1的磷酸化和核转位,而在H1975细胞中,PKCα的敲低则抑制了STAT1的磷酸化和核转位,表明PKCα调节PD-L1可能依赖于p53通路,此推测也通过外源性表达p53 R273H突变后引起PD-L1改变加以佐证。图3. p53 R273H调节PD-L1和STAT1PKCα对PD-L1的调控是通过作用于p53上游调节STAT1得以进行。Nutlin处理H1975细胞可以增加p53表达,导致STAT1的核转位减少,但不影响PKCα的表达。而敲低H1975细胞的PKCα后,p53表达增加,表明PKCα失活导致p53上调,从而抑制STAT1磷酸化,影响PD-L1的表达和在外泌体的分布。这一机制表明,通过调节PKCα和p53的相互作用,可以有效地抑制PD-L1的表达,从而削弱肿瘤细胞的免疫抑制能力。这一发现为开发新型肺癌免疫治疗药物提供了理论依据,有望通过靶向PKCα和p53的相互作用,增强机体对肿瘤的免疫反应,为肺癌患者提供更有效的治疗选择。PKCα regulates the secretion of PDL1-carrying small extracellular vesicles in a p53-dependent manner, Cell Death Dis. 2025 Jan 14;16(1):19. doi: 10.1038/s41419-025-07341-5.外泌体资讯网 Cell Death & Disease|澳门科技大学于海杰团队:PKCα通过p53调控PD-L1外泌体分泌