增生性瘢痕(Hypertrophic Scar,HS)是严重创伤及难愈性创面愈合后形成的纤维化疾病,其往往造成病变部位关节运动受限等功能障碍。尽管现有治疗方法在缓解HS方面取得了一定的效果,但由于HS的复杂性和个体差异,治疗仍然面临许多挑战。此外,HS的发病机制复杂,其中成纤维细胞的持续活化及其随后向肌成纤维细胞的分化被认为是促成胶原沉积、纤维化和HS形成的关键因素。因此,抑制成纤维细胞向肌成纤维细胞分化对于治疗HS至关重要。近年研究发现,外泌体能够调节成纤维细胞的活性,特别是通过调节miRNA等机制,可能为HS的治疗带来新思路。日前,河南省人民医院骨科刘涛教授团队联合中山大学附属第一医院创面修复外科谢举临教授团队在Journal of Nanobiotechnology杂志上发表题为“Epidermal stem cell derived exosomes-induced dedifferentiation of myofibroblasts inhibits scarring via the miR-203a-3p/PIK3CA axis”的论文,主要介绍了表皮干细胞来源的外泌体通过miR-203a-3p/PIK3CA信号轴诱导肌成纤维细胞去分化进而抑制创伤后HS形成。 第一作者为赵世新医师,通讯作者为刘涛及谢举临教授。
该研究强调了表皮干细胞来源外泌体(extracellular vesicles derived from epidermal stem cells, EpiSC-EVs)在HS中作为肌成纤维细胞调控因子的作用,并揭示了miR-203a-3p作为关键外泌体miRNA,其通过抑制PIK3CA表达并灭活PI3K/AKT/mTOR信号通路,在促进肌成纤维细胞去分化中发挥重要作用。具体而言,该研究首先证实PIK3CA的过表达和PI3K/AKT/mTOR信号通路的过度激活与HS的发生密切相关;其次,EpiSC-EVs能够诱导来源于HS的肌成纤维细胞去分化为静止的成纤维细胞;第三,miR-203a-3p被确认是EpiSC-EVs与肌成纤维细胞之间相互作用的关键成分;第四,miR-203a-3p通过靶向PIK3CA并抑制PI3K/AKT/mTOR通路发挥肌成纤维细胞的去分化作用。这些结果表明,富含miR-203a-3p的EpiSC-EVs通过抑制PIK3CA及后续失活PI3K/AKT/mTOR通路,减轻了过度HS的形成。
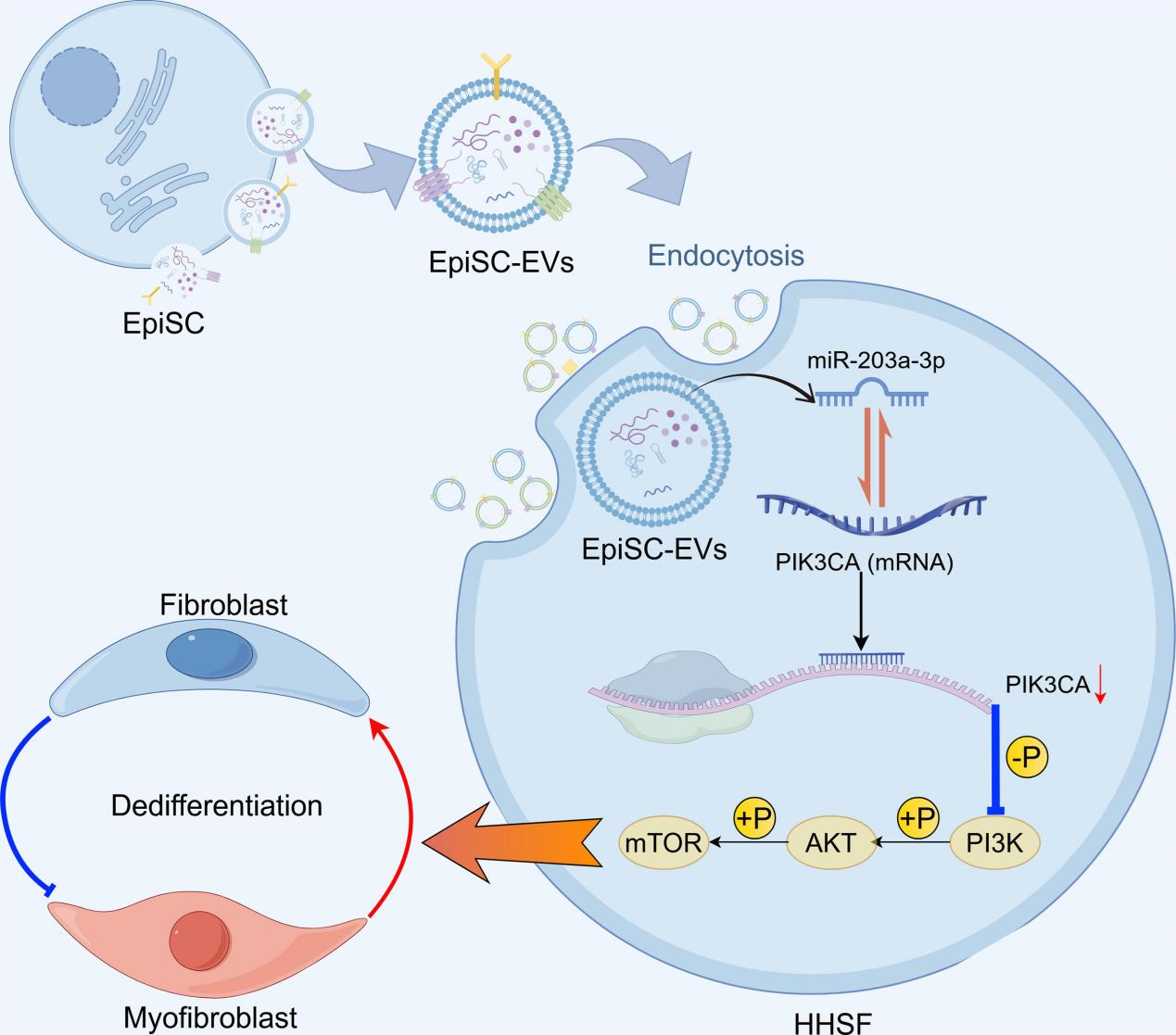
图1. EpiSC-EVs促进肌成纤维细胞去分化的机制示意图这项研究首次证实,EpiSC-EVs能够将功能性miR-203a-3p传递至HS中的肌成纤维细胞,通过降低PIK3CA的表达并促进其去分化。对推动负载miR-203a-3p的工程化EpiSC-EVs治疗HS的临床转化具有重要意义。参考文献:Epidermal stem cell derived exosomes-induced dedifferentiation of myofibroblasts inhibits scarring via the miR-203a-3p/PIK3CA axis. J Nanobiotechnology. 2025 Jan 29;23(1):56. doi: 10.1186/s12951-025-03157-9.
外泌体资讯网 J Nanobiotechnology|河南省人民医院刘涛/中山大学附一院谢举临:表皮干细胞来源外泌体抑制创伤后瘢痕形成





