衰老是生物体不可避免的生理过程,伴随多器官功能衰退和疾病风险升高。作为人体代谢的“中枢”,肝脏凭借强大的再生与解毒能力维持内环境稳态,但随着年龄增长,其功能逐渐退化:再生能力减弱、脂质代谢失衡、毒素清除效率下降,甚至可能引发脂肪肝、肝纤维化等疾病。近年研究发现,衰老细胞通过分泌“衰老相关分泌表型(SASP)”影响周围细胞,而细胞外囊泡(EVs)作为SASP的重要载体,成为揭示衰老机制的新焦点。microRNA(miRNA)是一类长度约22个核苷酸的非编码RNA,通过靶向结合mRNA调控基因表达,影响细胞增殖、分化和凋亡等关键过程。2023年诺贝尔生理学或医学奖授予了miRNA研究领域的先驱,表彰其揭示了这类“基因开关”在疾病与发育中的核心作用。近年研究发现,miRNA可通过细胞外囊泡(EVs)在细胞间传递信号,甚至远程调控器官功能,为衰老及相关疾病提供了全新视角。协和医院张抒扬教授团队联合清华大学药学院尹航教授团队开展合作,综合动物模型的发现,细胞水平的机制确认和临床数据验证,在BMC Biology杂志上发表题为“Delivering miR-23b-3p by small extracellular vesicles to promote cell senescence and aberrant lipid metabolism”的研究论文,该研究首次系统阐述了肝脏小细胞外囊泡中的miR-23b-3p在细胞衰老和脂质代谢异常中的重要作用,结合多组学分析与临床样本验证,揭示了一条新的细胞衰老调控通路和EV携带miR-23b-3p的双重病理角色,为理解肝脏衰老的分子机制提供了重要线索。文章通讯作者为协和医院药物研发与评价平台主任栾晓东、协和医院院长张抒扬教授、清华大学药学院尹航教授、协和医院心内科田庄教授。协和医院数字医学与人工智能中心金晔主任、内科临床博士后封思琴、心内科直博生唐牧云,清华大学博士毕业生陈彬娴、博士生孙高歌为文章共同第一作者。
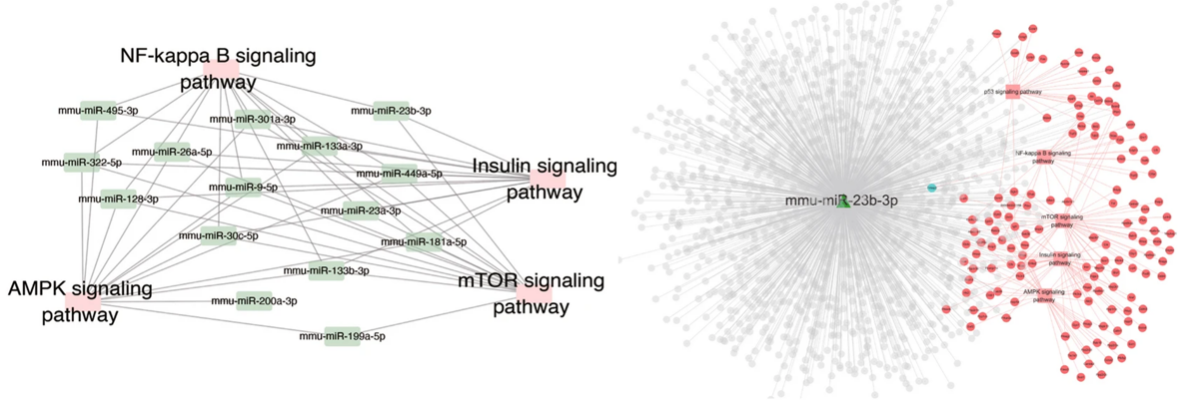
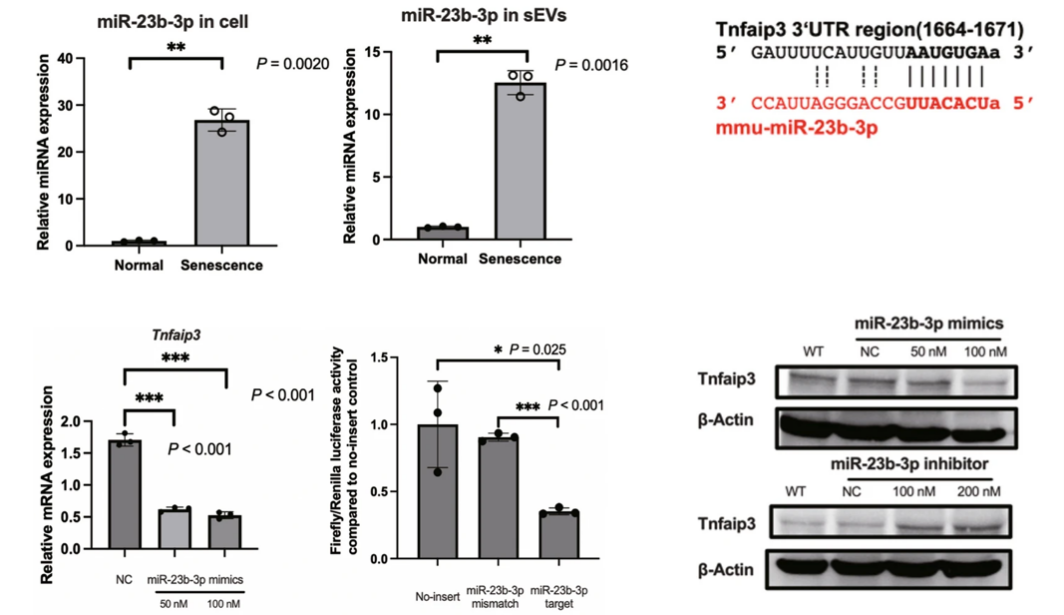
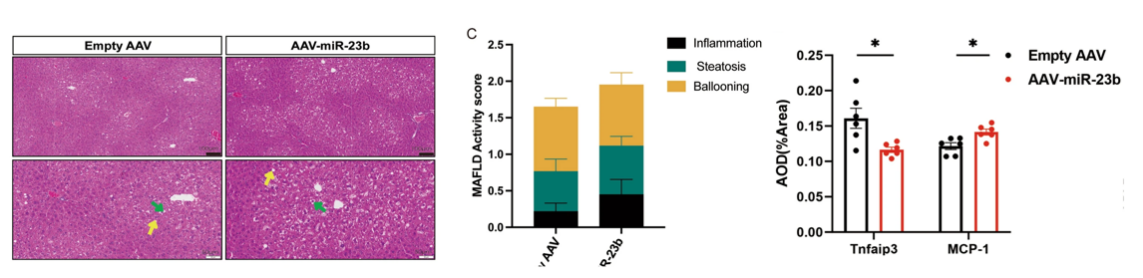
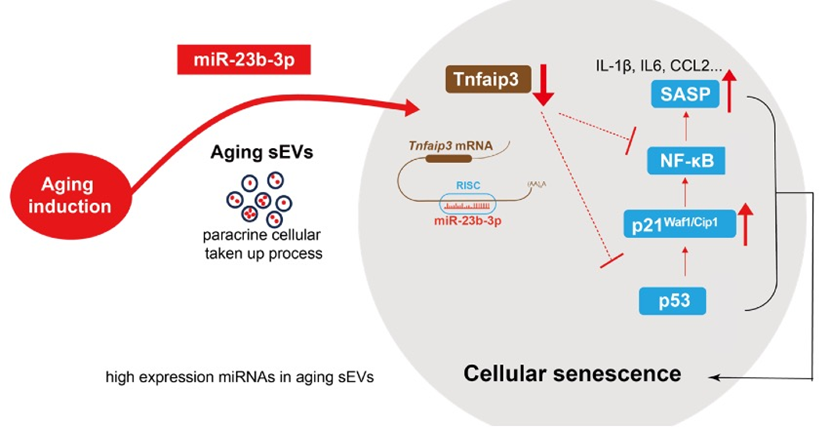
研究团队首先从不同年龄段的小鼠肝脏中提取了小细胞外囊泡(sEVs),并通过转录组和蛋白质组分析进行多组学分析(图1),构建了与衰老相关通路相关的miRNAs网络分析(图2)。老年组sEVs中miR-23b-3p的表达水平显著升高。进一步的细胞实验表明,miR-23b-3p通过靶向抑制抗炎蛋白Tnfaip3(A20)(图3),激活NF-κB信号通路,导致细胞周期停滞并诱发衰老表型。为了验证这一发现,研究团队构建了过表达miR-23b-3p的小鼠模型,结果显示,动物实验中过表达miR-23b-3p的小鼠的肝脏炎症反应显著增强,脂质代谢紊乱,甚至出现了早期脂肪肝病变(图4)。这些结果不仅揭示了miR-23b-3p在肝脏衰老中的关键作用,还为其作为衰老标志物的潜在应用提供了实验依据。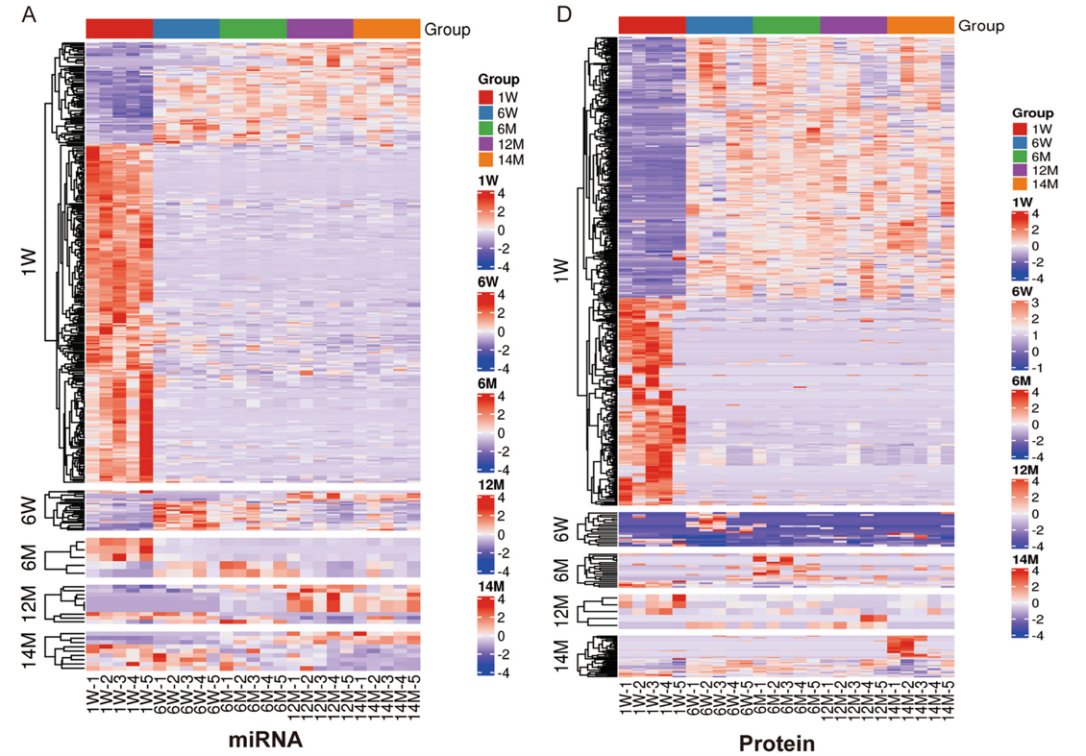
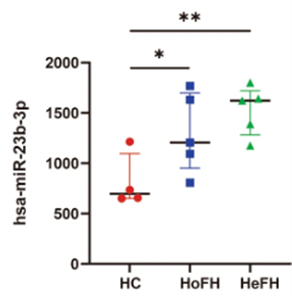
图1 不同年龄段小鼠肝脏sEVs的miRNA和蛋白质组学分析图2 与衰老相关通路相关的miRNAs网络分析。与衰老相关信号通路相关的蛋白是miR-23b-3p的靶标图3 细胞及其衍生sEVs中miR-23b-3p的升高,并通过实验验证miR-23b-3p调控下游Tnfaip3基因的分子机制图4 小鼠模型和疾病模型肝脏HE染色、MAFLD活动评分、Tnfaip3和MCP1的平均密度除了在肝脏衰老中的作用,研究团队还发现miR-23b-3p与代谢疾病密切相关。通过对家族性高胆固醇血症(FH)患者血液sEVs的分析,研究人员发现,这些患者血液中的miR-23b-3p水平显著高于健康对照组(图5)。进一步的机制研究表明,miR-23b-3p可能通过干扰低密度脂蛋白受体(LDLR)的表达,加剧脂质代谢异常,从而增加心血管疾病的风险。这一发现不仅为肝脏衰老提供了新的分子标志物,还为心血管疾病、代谢综合征等年龄相关疾病的治疗开辟了新思路。研究团队认为,靶向抑制miR-23b-3p可能成为延缓衰老进程并改善代谢功能的有效策略。图5 FH患者血液sEVs中miR-23b-3p的RT-qPCR检测。HoFH:纯合子FH患者。HeFH:杂合子FH患者EVs能够运输miRNA,通过旁分泌被周围细胞摄取,调控下游的基因表达。研究发现肝脏组织EVs携带的差异表达miRNA在衰老和癌症相关通路中富集,反映了细胞的衰老状态。通过对miRNA和蛋白数据的综合分析,研究识别了相互连接的miRNA和蛋白簇,以及特定的miRNA-蛋白对,揭示了复杂的调控网络。进一步发现miR-23b-3p与Tnfaip3之间的相互作用机制,表明miR-23b-3p通过RNA靶向基因相互作用表观遗传调控Tnfaip3的表达,并促进细胞周期停滞,加速细胞衰老。在小鼠模型中,miR-23b-3p对衰老的影响得到了进一步验证,肝脏的炎症反应更为明显,表明miR-23b-3p在脂质代谢中的重要作用。此外,家族性高胆固醇血症(FH)患者血液EVs中miR-23b-3p的高表达提示其可能影响脂质代谢并促进细胞衰老,从而增加与年龄相关疾病的风险。图6 miR-23b-3p被衰老细胞外囊泡携带进入受体细胞,影响衰老进程该研究为理解细胞外囊泡在衰老过程中的作用提供了新的视角,并揭示了EV携带miR-23b-3p在细胞衰老和脂质代谢中的关键作用。未来的研究可以进一步探索miR-23b-3p在不同组织和器官中的具体功能,以及其在其他与年龄相关疾病中的作用机制。miR-23b-3p有望成为衰老相关疾病和脂质代谢紊乱的生物标志物。通过检测体内miR-23b-3p的水平,医生可以更准确地评估患者的衰老程度和疾病风险。针对miR-23b-3p的干预措施可能为改善年龄相关的肝功能障碍和相关代谢异常提供新的治疗策略。从微观的miRNA到宏观的器官衰老,这项研究不仅深化了对肝脏老化机制的理解,更凸显了细胞外囊泡作为“细胞信使”在疾病干预中的巨大潜力。或许不久的将来,调控一颗小小的RNA分子,就能为人类健康寿命按下“暂停键”。Delivering miR-23b-3p by small extracellular vesicles to promote cell senescence and aberrant lipid metabolism. BMC Biol 23, 41 (2025). https://doi.org/10.1186/s12915-025-02143-9外泌体资讯网 BMC Biology|协和医院/清华大学团队:EV携带miR-23b-3p调控细胞衰老通路