细胞外囊泡(Extracellular vesicles,EVs)是由大多数细胞分泌的纳米级囊泡,包括外泌体、微囊泡和凋亡小体,它们携带脂质、DNA、RNA、蛋白质和代谢产物等。EVs在细胞间通信中起关键作用,参与多种疾病(如癌症、心血管疾病和神经退行性疾病)的病理过程。血浆来源的EVs富含丰富的生物信息,是研究疾病机制、发现生物标志物的重要来源。但是,血浆成分复杂,包含高丰度的血浆蛋白和脂蛋白等干扰物质,使得EVs的分离与纯化成为一大挑战。尽管已经开发了很多从血浆中分离和纯化EV的方法,如超速离心(Ultracentrifugation,UC)、沉淀法、化学亲和纯化法和体积尺寸排阻色谱法等,但血浆EV的分离仍然存在一些挑战。例如,传统方法耗时长,分离纯度低,污染物与EV共分离时等。这些问题严重阻碍了基于血浆的蛋白质组学研究。2025年2月6日,东南大学张昊、朱叶飞和余艺文在国际学术期刊Analytical Chemistry发表题为“High-Efficiency Capture and Proteomic Analysis of Plasma-Derived Extracellular Vesicles through Affinity Purification”的研究论文。该研究开发了一种新型的亲和磁珠EVlent(Extracellular Vesicles isoLatedEfficiently, Naturally, and Totally),解决了现有血浆EVs分离技术存在的兼容性和纯度问题。
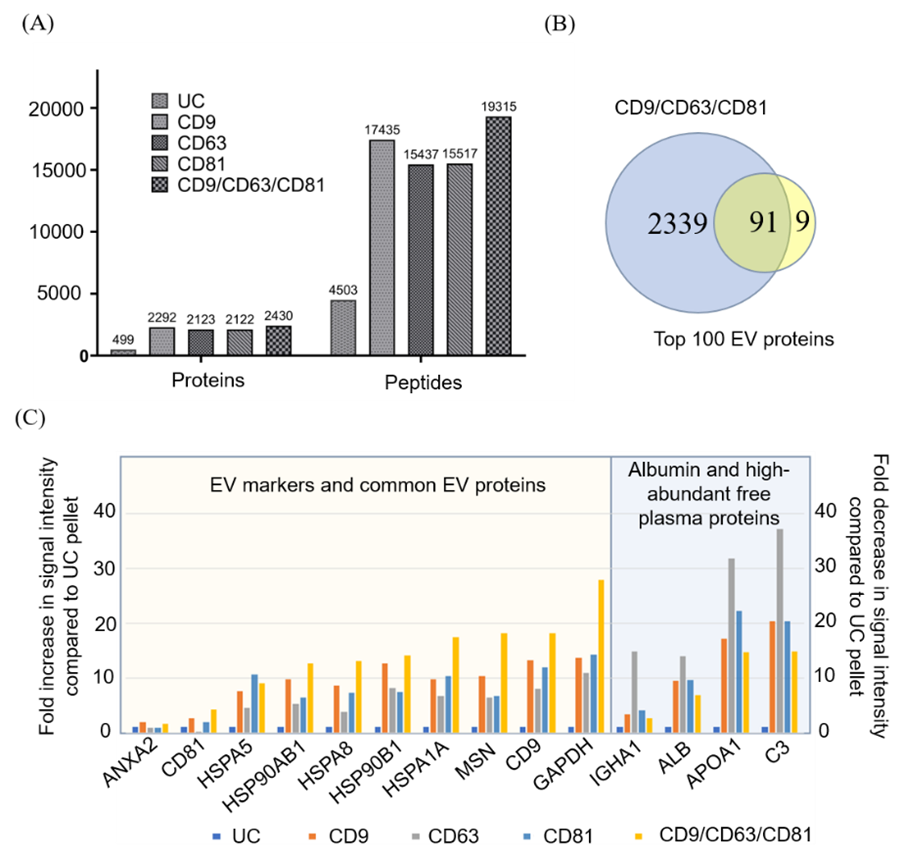
为了高效的捕获血浆中的EVs,该亲和磁珠EVlent表面通过同时修饰了3种不同的抗体CD9、CD63和CD81,实现了从血浆中快速、高效地捕获EVs。分别制备了4种不同的亲和磁珠,前3种分别单独修饰单一抗体,第4种同时修饰了3种抗体。为了比较它们的性能,分别利用4种亲和磁珠对血浆中的EV进行捕获和蛋白质组学分析,UC的方法作为对照。从结果可以看出,同时修饰了3种抗体的亲和磁珠具有最高的蛋白和肽段鉴定量,UC的方法最差(图1.A),并且包含了Vesiclepedia数据库Top100中的91种常见蛋白(图1.B)。此外,与UC方法相比,利用亲和磁珠的策略可以明显提高EV蛋白的丰度和减少血浆中的污染物(例如白蛋白、血浆蛋白和脂蛋白)的丰度(图1.C)。血浆是一种珍贵的生物样本,为了能够适合大规模的临床检测,微量样本的蛋白质组学分析尤其重要。该论文分别评价了不同体积血浆中EV蛋白的鉴定量,从结果可以看出(图2),随着血浆体积的增加,蛋白和肽段数量整体呈现上升趋势,当血浆体积大于100 μL时,蛋白和肽段上升呈平缓趋势。100 μL血浆可以鉴定到高达2000多个蛋白和15000多条肽段,即使5 uL的血浆也可以鉴定到约1000个蛋白。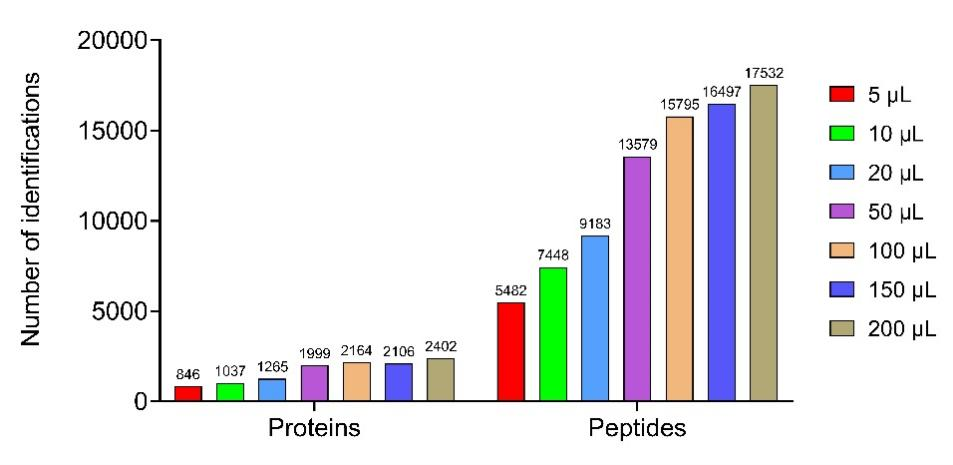 接下来,该研究利用EVlent磁珠分别对正常人和PD患者的血浆进行EV的捕获和蛋白质组学分析,成功筛选出了PD疾病潜在的生物标志物。总体而言,该方法可快速、高效地从血浆中分离出EV,即使用少量的血浆(5 μL),也能鉴定出近1000种蛋白质。此外,该方法优于传统的UC方法,显著减少了血浆中白蛋白和脂蛋白的污染。该策略在血浆EV分离中表现出优异的性能、高灵敏度和特异性。它在各种癌症的早期筛查和诊断方面具有广阔的应用前景。图3. 基于EVlent的血浆EV分离、表征及蛋白质组学分析流程东南大学张昊、朱叶飞和余艺文是论文的共同通讯作者。东南大学张贵元、南京大学医学院附属鼓楼医院马承晓和上海锦测医学检验所马乐是论文的共同第一作者。该研究中的EVlent产品已经在逸微健华公司(EVLiXiR)商业化。High-Efficiency Capture and Proteomic Analysis of Plasma-Derived Extracellular Vesicles through Affinity Purification. Anal Chem. 2025 Feb 5. doi: 10.1021/acs.analchem.4c04269.
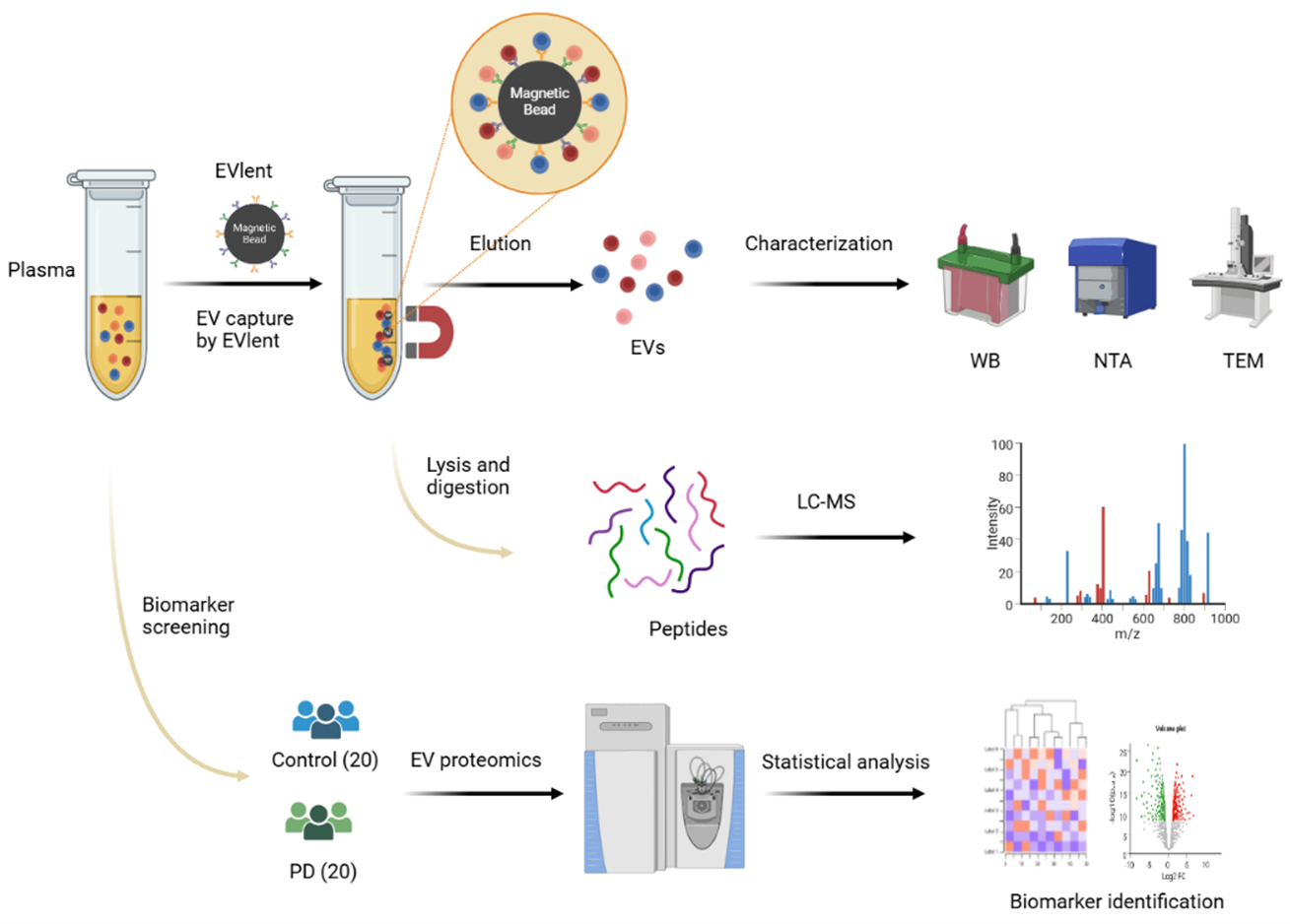
接下来,该研究利用EVlent磁珠分别对正常人和PD患者的血浆进行EV的捕获和蛋白质组学分析,成功筛选出了PD疾病潜在的生物标志物。总体而言,该方法可快速、高效地从血浆中分离出EV,即使用少量的血浆(5 μL),也能鉴定出近1000种蛋白质。此外,该方法优于传统的UC方法,显著减少了血浆中白蛋白和脂蛋白的污染。该策略在血浆EV分离中表现出优异的性能、高灵敏度和特异性。它在各种癌症的早期筛查和诊断方面具有广阔的应用前景。图3. 基于EVlent的血浆EV分离、表征及蛋白质组学分析流程东南大学张昊、朱叶飞和余艺文是论文的共同通讯作者。东南大学张贵元、南京大学医学院附属鼓楼医院马承晓和上海锦测医学检验所马乐是论文的共同第一作者。该研究中的EVlent产品已经在逸微健华公司(EVLiXiR)商业化。High-Efficiency Capture and Proteomic Analysis of Plasma-Derived Extracellular Vesicles through Affinity Purification. Anal Chem. 2025 Feb 5. doi: 10.1021/acs.analchem.4c04269.外泌体资讯网 Analytical Chemistry|东南大学张昊/朱叶飞/余艺文在血浆细胞外囊泡的蛋白质组学研究中取得突破