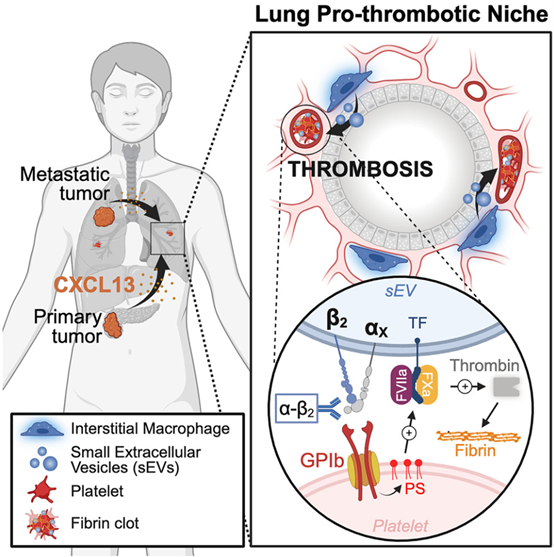
癌症是一种影响全身的疾病,不仅限于肿瘤原发部位,还会引发其他并发症。在某些癌症(如胰腺导管腺癌PDAC)和晚期患者中,血栓形成是导致死亡的第二大原因。来自美国威尔康奈尔医学院的David Lyden教授领衔、联合纪念斯隆凯特琳癌症中心、爱因斯坦医学院、加州大学圣地亚哥分校等20余家机构的40余位科学家完成的一项最新研究显示,首次揭示了肺癌患者中高发血栓及转移的关键机制:肺间质巨噬细胞(IMs)分泌的携带激活态整合素β2的小细胞外囊泡(sEVs),通过与血小板表面受体GPIb直接结合,触发全身性血栓形成,并促进癌症转移。研究还发现,血浆sEV中整合素β2的水平可预测胰腺癌等患者的血栓风险,而靶向β2的抗体治疗能有效预防血栓并抑制转移。这一发现为癌症并发症的诊疗提供了全新策略。相关内容以“Extracellular vesicles from the lung pro-thrombotic niche drive cancer-associated thrombosis and metastasis via integrin beta 2”为题在线发表于2月10日的国际顶级学术期刊Cell杂志上。
癌症相关的血栓形成部分是由于肿瘤细胞与血小板之间的相互作用。血小板在肿瘤信号(如粘附蛋白和促聚集因子)的刺激下聚集,进而促进肿瘤的扩散和生长。这种肿瘤-血小板的相互作用形成了一个恶性循环,加速了疾病的进展和死亡。血栓性并发症,尤其是弥散性血管内凝血(DIC)和血栓栓塞(TE),是癌症患者死亡的主要原因。DIC是一种全身性综合征,表现为微血栓在多个器官中形成,导致血液供应不足、器官衰竭以及因凝血因子和血小板耗尽而引发的出血。DIC通常在明显的血栓栓塞事件之前发生,并与较差的预后相关。尽管DIC在7%–20%的实体瘤患者中被诊断出来,但尸检结果显示几乎所有癌症患者都有潜在的DIC。
相比之下,癌症相关的TE通常是明显的,尤其是在胰腺癌、肺癌和脑癌患者中,TE的风险较高。乳腺癌和黑色素瘤患者的TE风险较低,但仍存在一定风险。无论癌症类型如何,晚期癌症患者的血栓形成风险都显著增加,这表明血栓形成与癌症转移之间存在密切联系。无论是明显的还是隐匿的血栓事件,都会缩短患者的生存期并增加死亡率。此外,50%的TE幸存者(包括接受抗凝治疗的患者)会发展为血栓后综合征,导致长期虚弱和更高的死亡率。尽管抗凝治疗可以降低血栓形成和转移的风险,但由于缺乏有效的风险预测生物标志物以及抗凝治疗可能引发的出血风险,亚临床DIC的诊断和血栓预防仍然是临床上的难题。
血栓形成的风险增加与多种机制有关,包括止血因子(如组织因子TF和表皮淋巴管蛋白podoplanin)的突变。虽然这些因子在肿瘤细胞中的高表达可以解释肿瘤内部的血栓形成,但它们在循环细胞外囊泡(EVs)中的存在可能解释了全身性血栓形成的模式。外泌体或小型EVs(sEVs)在细胞间通讯中起重要作用,并在系统性疾病中具有治疗和预测潜力。TF通常与癌症患者血液中的外泌体结合,但并非所有研究都发现TF与癌症相关TE风险之间的明确关联,这表明可能存在其他不依赖于TF的血栓形成机制。先前的研究表明,sEVs可以通过不依赖于TF的途径引发凝血和血小板聚集,但它们在癌症相关血栓形成中的预测价值尚不明确。此外,肿瘤微环境中非癌细胞来源的外泌体的促凝特性仍是一个未被充分研究但具有重要临床意义的领域。
这项研究发现,来自非转移性和转移性肿瘤小鼠以及癌症患者的肺部巨噬细胞(IMs)分泌的sEVs是血栓形成风险升高的关键因素,提示肺部是癌症相关血栓形成的主要发源地。研究团队发现,sEV表面的活化整合素β2是血栓形成的启动因子。通过选择性阻断整合素β2,不仅可以预防血栓形成,还能减少转移性疾病的发生。
研究还发现,来自肿瘤小鼠和癌症患者的肺部sEVs上的αXβ2二聚体与血小板上的糖蛋白(GP)Ib相互作用,启动血小板聚集。此外,PDAC患者血浆中sEVs的β2水平升高与随后的TE事件相关。因此,肺部sEVs中的整合素β2不仅是一个潜在的血栓风险预测标志物,还可能成为预防血栓和转移的治疗靶点。该研究主要内容包括:
- 肺来源sEVs直接诱发全身性血栓
研究团队通过多种癌症模型(包括胰腺癌、黑色素瘤、乳腺癌小鼠),发现肺组织(无论是否转移)分泌的sEVs具有强促血栓活性。将这类sEVs注射至健康小鼠后,5分钟内即引发呼吸衰竭和死亡,并伴随血小板减少、D-二聚体升高(血栓标志物)及多器官微血栓形成。进一步通过活体显微镜观察发现,sEVs在肺血管中快速诱导血小板聚集,形成阻塞性血栓。
- 整合素β2是sEV促血栓的核心因子
通过质谱分析、超高分辨率显微镜(dSTORM)等技术,团队发现促血栓sEVs表面富集激活态整合素β2,且β2以簇状形式分布,提示其处于功能活跃状态。阻断β2后,sEVs无法诱导血小板聚集,小鼠血栓发生率下降50%,生存期显著延长。值得注意的是,β2抗体治疗未引起出血等副作用,安全性优于传统抗凝药物。
- 肺间质巨噬细胞(IMs)是sEVs的主要来源
单细胞测序和流式分析显示,肿瘤微环境中的IMs被重编程为M2样表型,高表达整合素β2并大量分泌sEVs。通过靶向清除IMs(抗CSF1R抗体)或抑制其激活因子CXCL13,可完全阻断sEVs的促血栓活性。进一步实验证实,肿瘤分泌的CXCL13通过血液循环到达肺部,驱动IMs增殖和β2表达上调,形成系统性促血栓微环境。
- β2与血小板GPIb直接互作触发凝血级联反应
利用光催化邻近标记技术(μMap)和原子力显微镜(AFM),团队发现sEV表面的整合素β2与αX亚基形成异源二聚体,直接结合血小板表面受体GPIb。这一互作引发血小板活化、磷脂酰丝氨酸(PS)暴露,进而招募凝血因子(如TF/FVIIa/FXa),最终导致纤维蛋白沉积和血栓扩大。阻断GPIb或β2可有效抑制该过程。
- 临床验证:血浆sEV-β2水平预测血栓风险
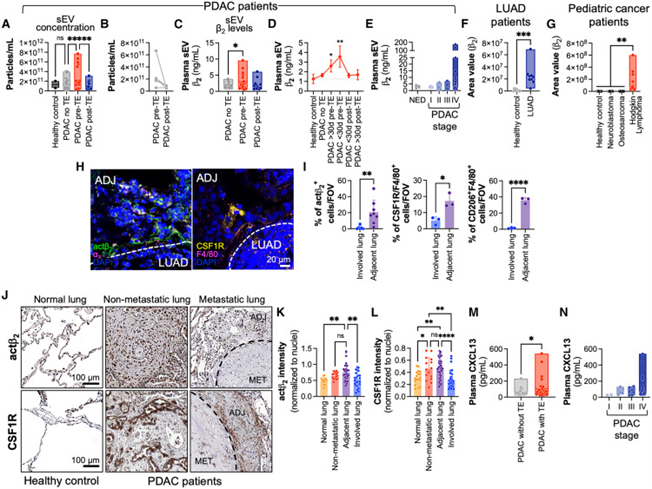
在胰腺癌患者队列中,血栓事件发生前30天,患者血浆sEV中β2水平显著升高,且与癌症分期正相关。类似现象也见于肺癌、霍奇金淋巴瘤等高血栓风险癌种。此外,肿瘤邻近肺组织中IMs的β2表达量远高于转移灶,提示PTN形成是全身性癌症进展的结果。
参考文献:Extracellular vesicles from the lung pro-thrombotic niche drive cancer-associated thrombosis and metastasis via integrin beta 2. Cell. 2025 Feb 10:S0092-8674(25)00094-7.
外泌体资讯网 Cell丨细胞外囊泡促发肺癌相关的全身性血栓形成