肿瘤来源细胞外囊泡(T-EVs)的PD-L1蛋白是预测免疫治疗反应的重要生物标志物。然而,由于存在大量非肿瘤来源EV的干扰,准确分析复杂体液中T-EVs来源的PD-L1仍然具有挑战性。因此,开发一种灵敏、准确的用于监测T-EVs来源的PD-L1的传感器,对于更精确的诊疗发展具有重要意义。
近期,扬州大学舒韵副教授团队报道了一种基于双适配体邻位连接技术(Proximity Ligation Assay, PLA)介导的滚环扩增策略(RCA),用于血清样本中EpCAM和PD-L1双阳性T-EVs含量的分析,并且在没有额外纯化的情况下可以准确区分癌症患者和健康人的样本。该项研究以“Aptamer-Proximity Ligation Coupled with Rolling Circle Amplification Strategy for Ultrasensitive Analysis of Tumor-Derived Extracellular Vesicles PD-L1”为题发表在 Analytical Chemistry 上。扬州大学舒韵副教授和徐琴教授为论文通讯作者,2021级博士研究生叶明理为论文第一作者。
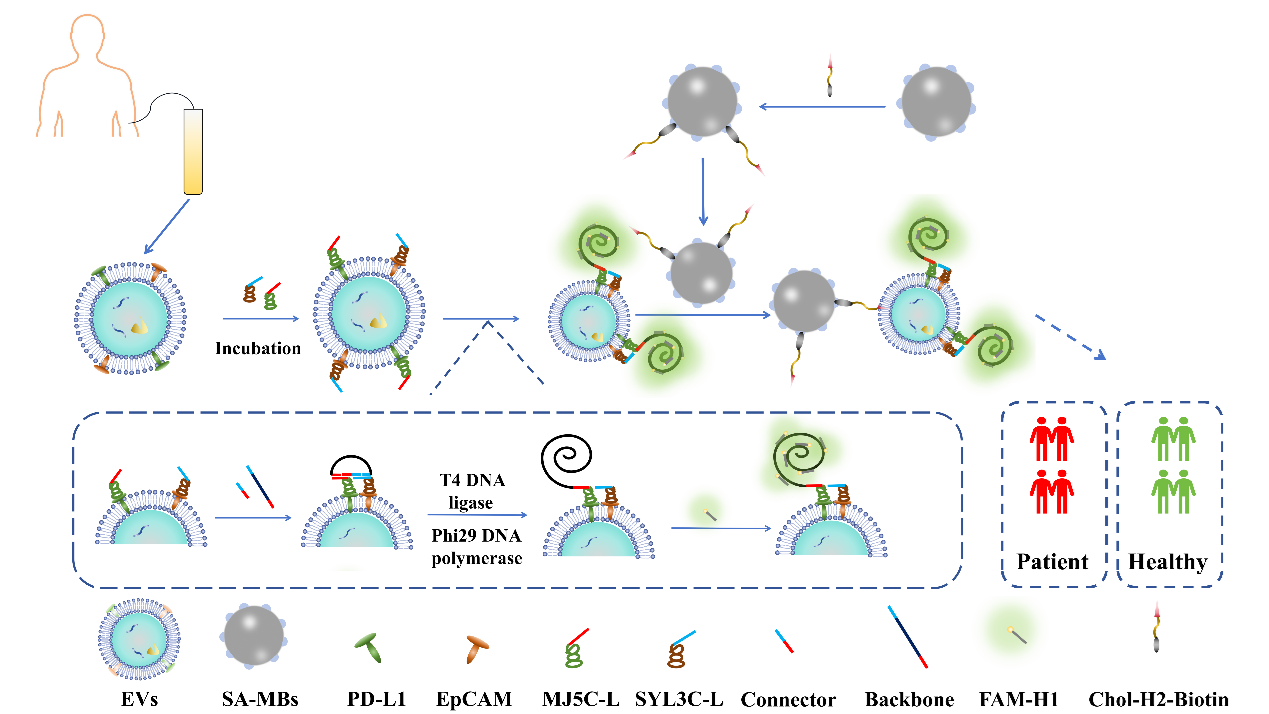
首先,作者使用具有强结合亲和力的双适配体序列识别A375 EVs表面的EpCAM和PD-L1蛋白。然后通过连接序列触发基于适配体的PLA,并加入骨架序列和T4 DNA连接酶形成圆形模板,DNA探针的延长端可以通过Phi29 DNA聚合酶和游离核苷酸与模板结合以启动RCA。最后使用胆固醇修饰的磁珠对EVs进行高效分离。借助基于双适配体PLA介导的RCA的高信号放大能力和高效的磁分离,该生物传感器能够高灵敏度定量检测T-EVs来源PD-L1。此外,还证明了其特异性和在临床样本中的实际应用。该策略具有高灵敏度和简便的优势,在癌症的现场即时诊断(POCT)和评估免疫治疗反应方面展示出巨大的潜力。
图1:基于适配体邻位连接介导的滚环扩增策略用于肿瘤来源细胞外囊泡PD-L1检测的示意图。
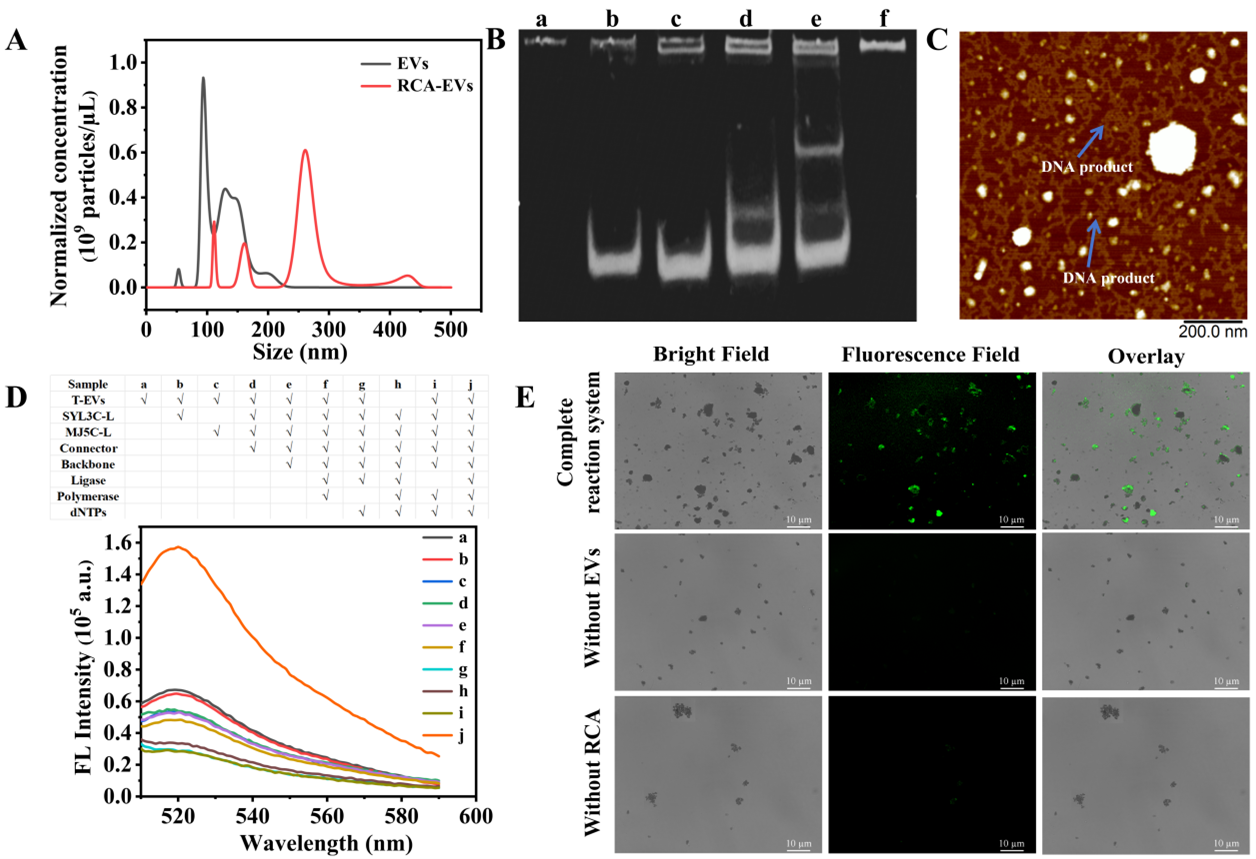
图2:(A-C)验证EV上成功进行aptamer-PLA-guided RCA;(D-E)磁珠捕获RCA-EVs的荧光和显微镜表征结果
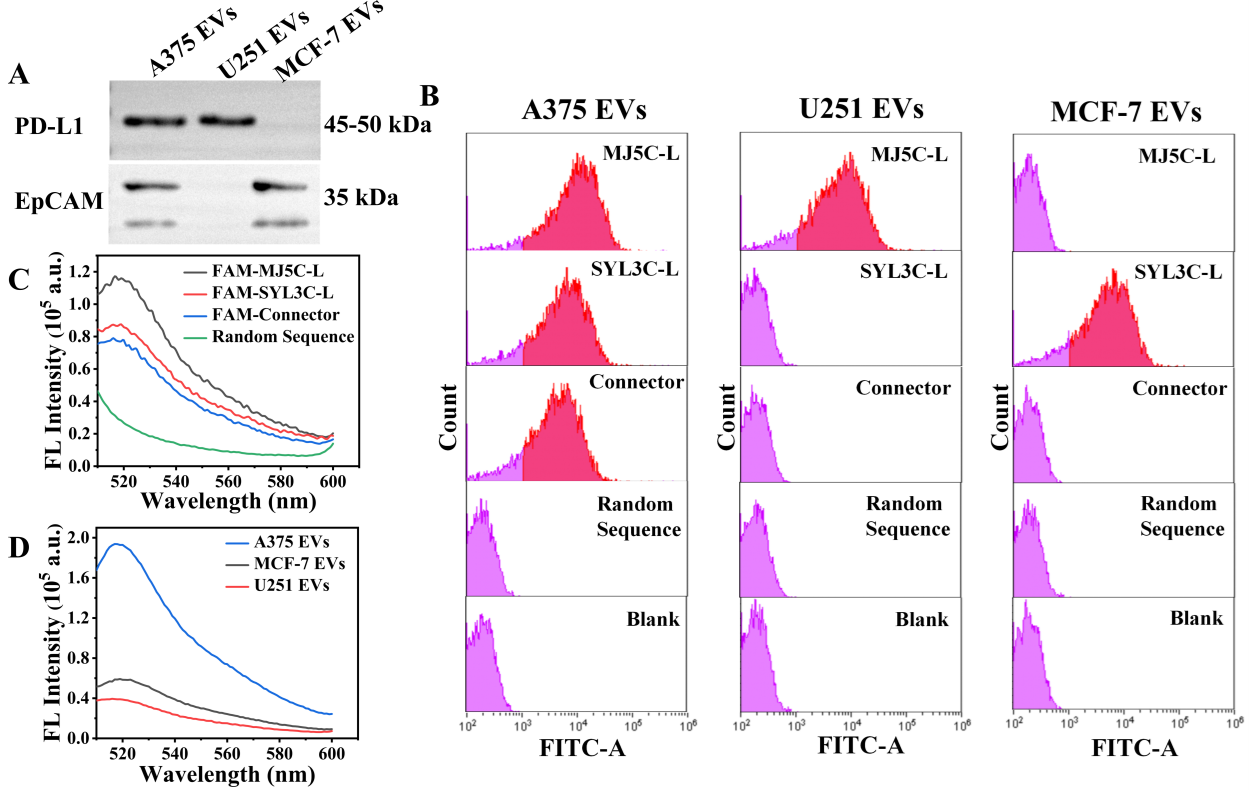
图3:(A-B)A375, U251 and MCF-7 EVs的Western blot和荧光流式表征结果;(C)所设计序列对A375 EVs特异性验证;(D)该方法特异性结果
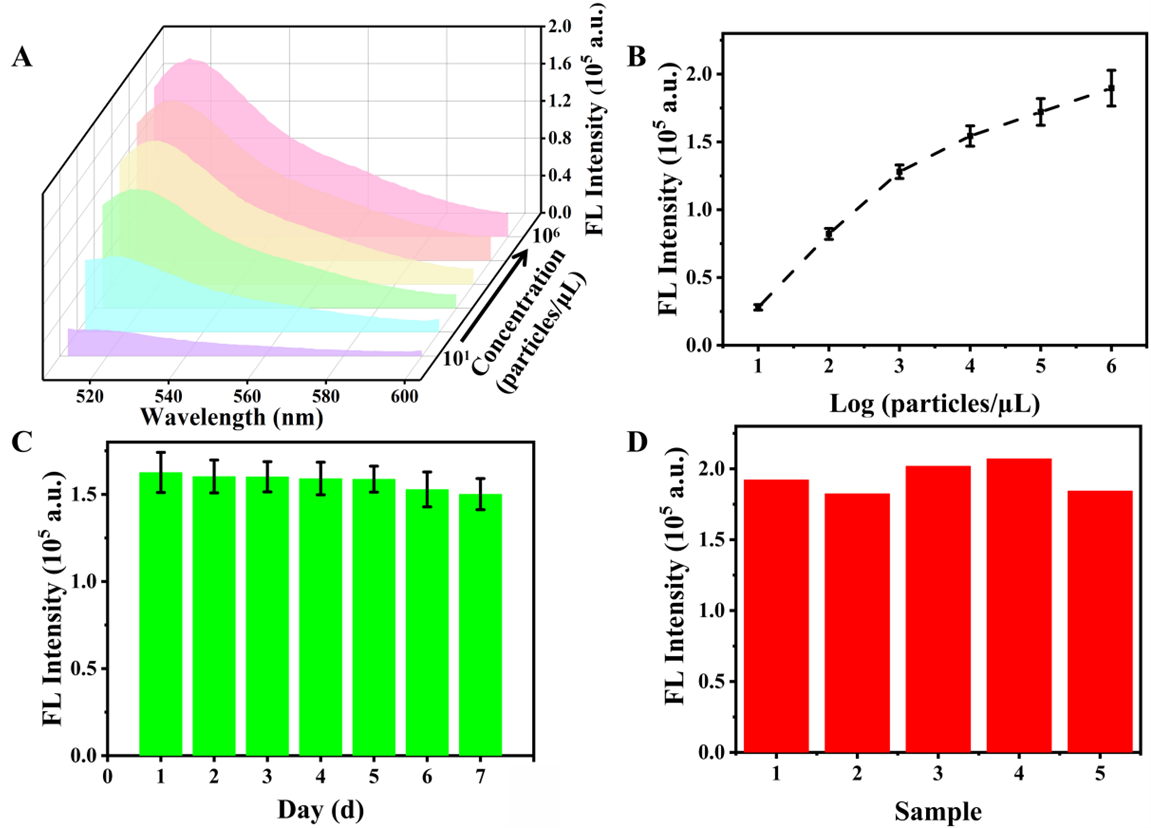
图4:(A-B)不同浓度T-EVs PD-L1的荧光强度变化及标准曲线。(C-D)该生物传感器的稳定性和重现性分析。
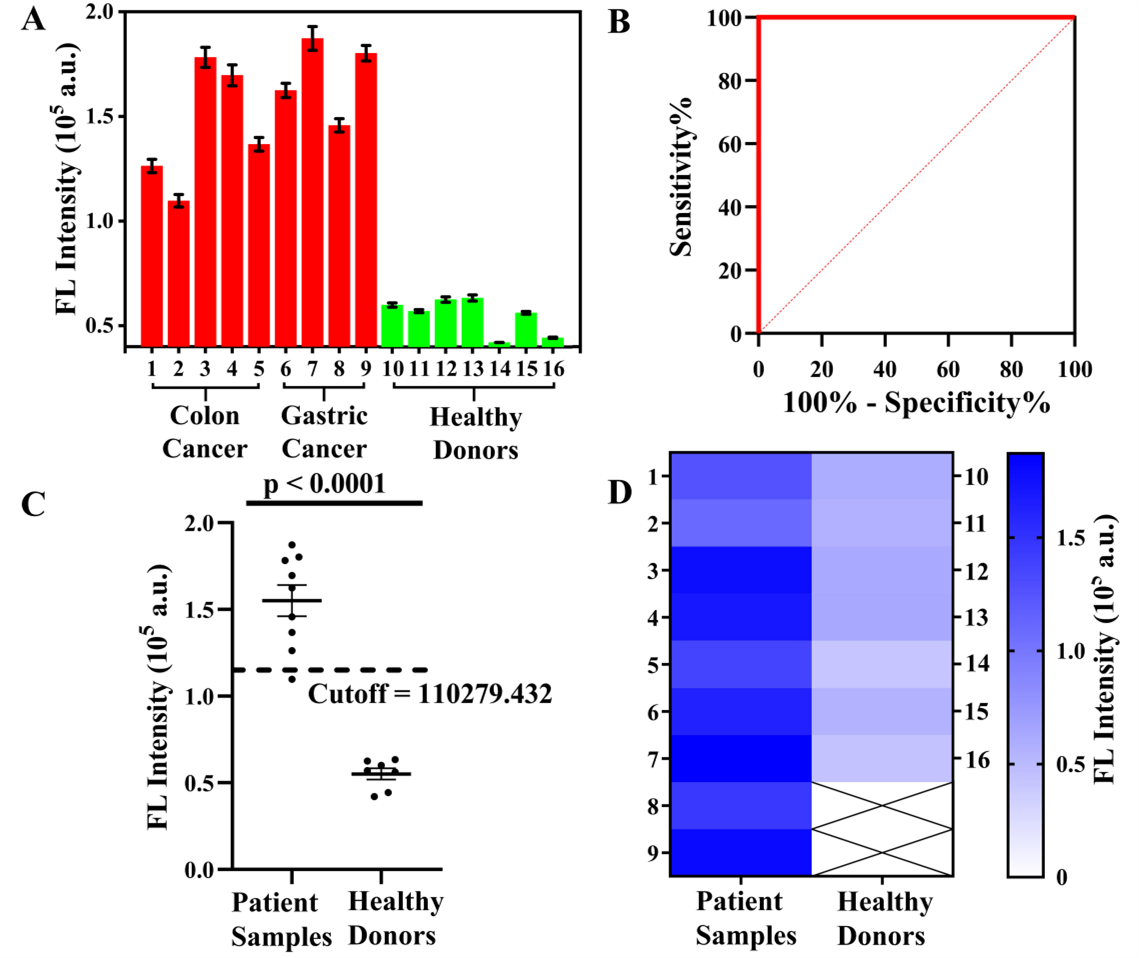
图5:(A)癌症患者(No. 1-9)和健康人(No. 10-16)血清样本的检测结果。(B)ROC分析曲线。(C)癌症患者和健康人血清样本检测结果对比。(D)对应热图。
综上所述,作者开发了一种基于适配体PLA介导的RCA策略,用于超灵敏定量分析T-EVs来源的PD-L1。首先,使用双适配体高亲和力结合T-EVs表面EpCAM和PD-L1蛋白,然后触发基于适配体的PLA和RCA。此外,用胆固醇锚定的磁珠用于实现T-EVs的高性能分离。因此,该方法实现了T-EVs的高灵敏定量分析,检测限为7.5 EVs·μL-1。此外,该策略对同时表达EpCAM和PD-L1蛋白的EVs表现出高特异性,并可以100%准确地区分癌症患者和健康供体样本。该策略有望为癌症的早期诊断和治疗提供一个新的液体活检分析平台。
参考文献:
Aptamer-Proximity Ligation Coupled with Rolling Circle Amplification Strategy for Ultrasensitive Analysis of Tumor-Derived Extracellular Vesicles Sourced PD-L1, Analytical Chemistry, 2025 Feb 4;97(4):2343-2350.
外泌体资讯网 Anal Chem|扬州大学舒韵副教授团队:基于适配体邻位连接技术介导的滚环扩增策略用于肿瘤来源细胞外囊泡PD-L1的超灵敏分析