骨关节炎(OA)的治疗面临巨大挑战,目前缺乏有效修复关节软骨损伤的方法。炎症是OA诱导软骨退化和滑膜炎症的关键驱动因素。近年来,人脐带间充质干细胞(HucMSCs)来源的外泌体被认为是一种极具潜力的无细胞治疗策略。然而,其临床应用受到获取足够数量、具有针对性治疗效果的外泌体这一难题的限制。HucMSCs对微环境信号高度敏感,其分泌的外泌体中miRNA的种类及表达水平可随外界刺激而动态调控。因此,在促炎环境下,有可能诱导HucMSCs分泌具有更强抗炎特性的外泌体,从而调节OA炎症微环境,促进软骨再生。
受此启发,四川大学生物医学工程学院/国家生物医学材料工程技术研究中心王启光副研究员、樊渝江教授团队为该问题的解决开发了一种新的策略,相关工作以“Remodeling the Proinflammatory Microenvironment in Osteoarthritis through Interleukin-1 Beta Tailored Exosome Cargo for Inflammatory Regulation and Cartilage Regeneration”为题发表在ACS Nano上(DOI: 10.1021/acsnano.4c16785),文章第一作者是四川大学博士研究生陈曼雨和锦州医科大学第三附属医院外科医生刘宇涵,研究工作受到国家重点研发计划和国家自然基金的支持。
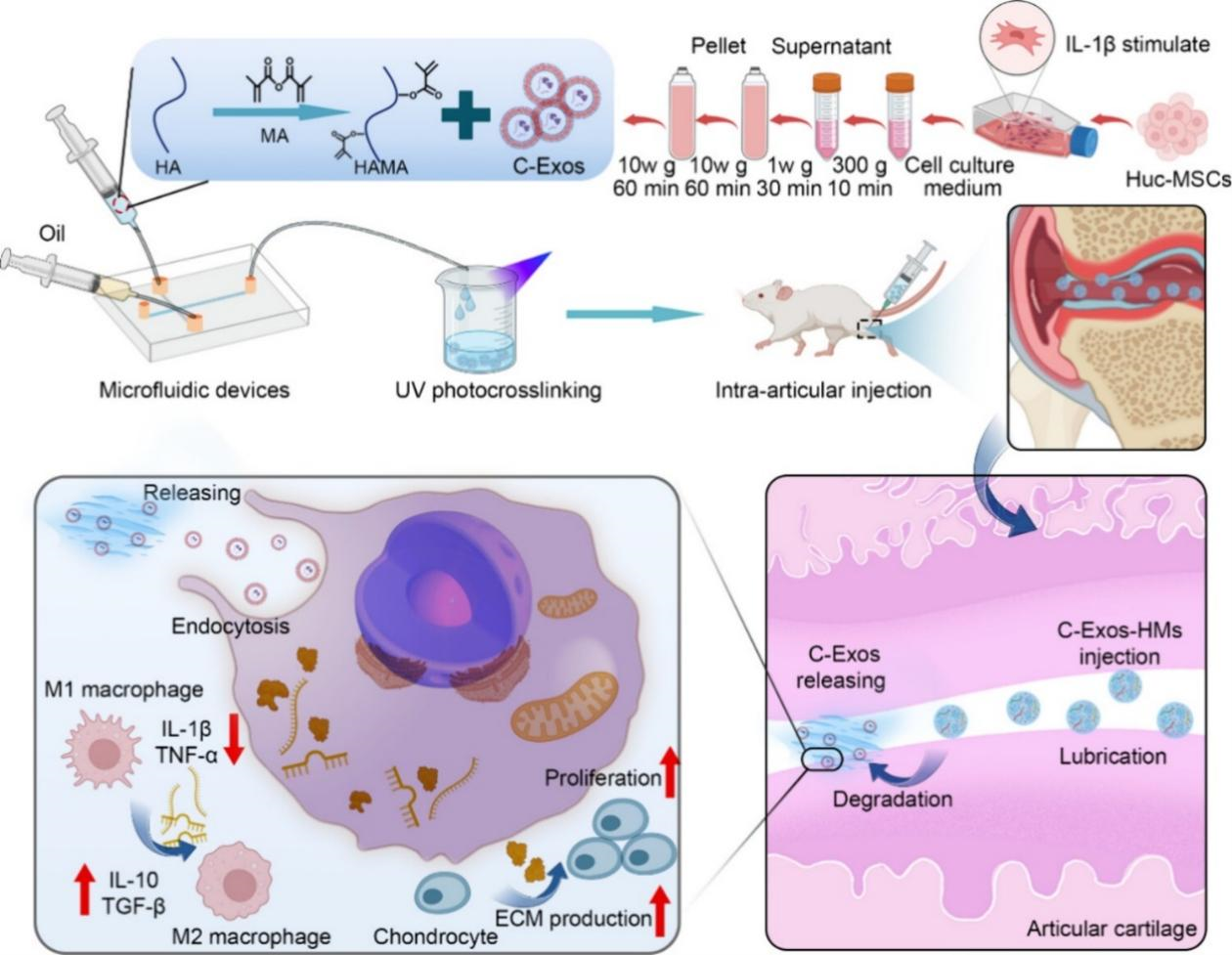
研究者从IL-1β预刺激的HucMSCs中分离出外泌体(C-Exos),并将其装载于透明质酸(HA)水凝胶微球中(C-Exos-HMs)。HA水凝胶微球的引入不仅能够增强关节运动的润滑性,还可通过缓释C-Exos延长其生物活性和治疗作用。C-Exos中功能成分的协同作用结合HA水凝胶的润滑特性,可有效调控炎症反应,促进软骨相关基质的生成,从而加速软骨再生,实现对OA的高效治疗。(图1)。
图1. C-Exos-HMs通过调节骨关节炎的炎症微环境促进软骨再生
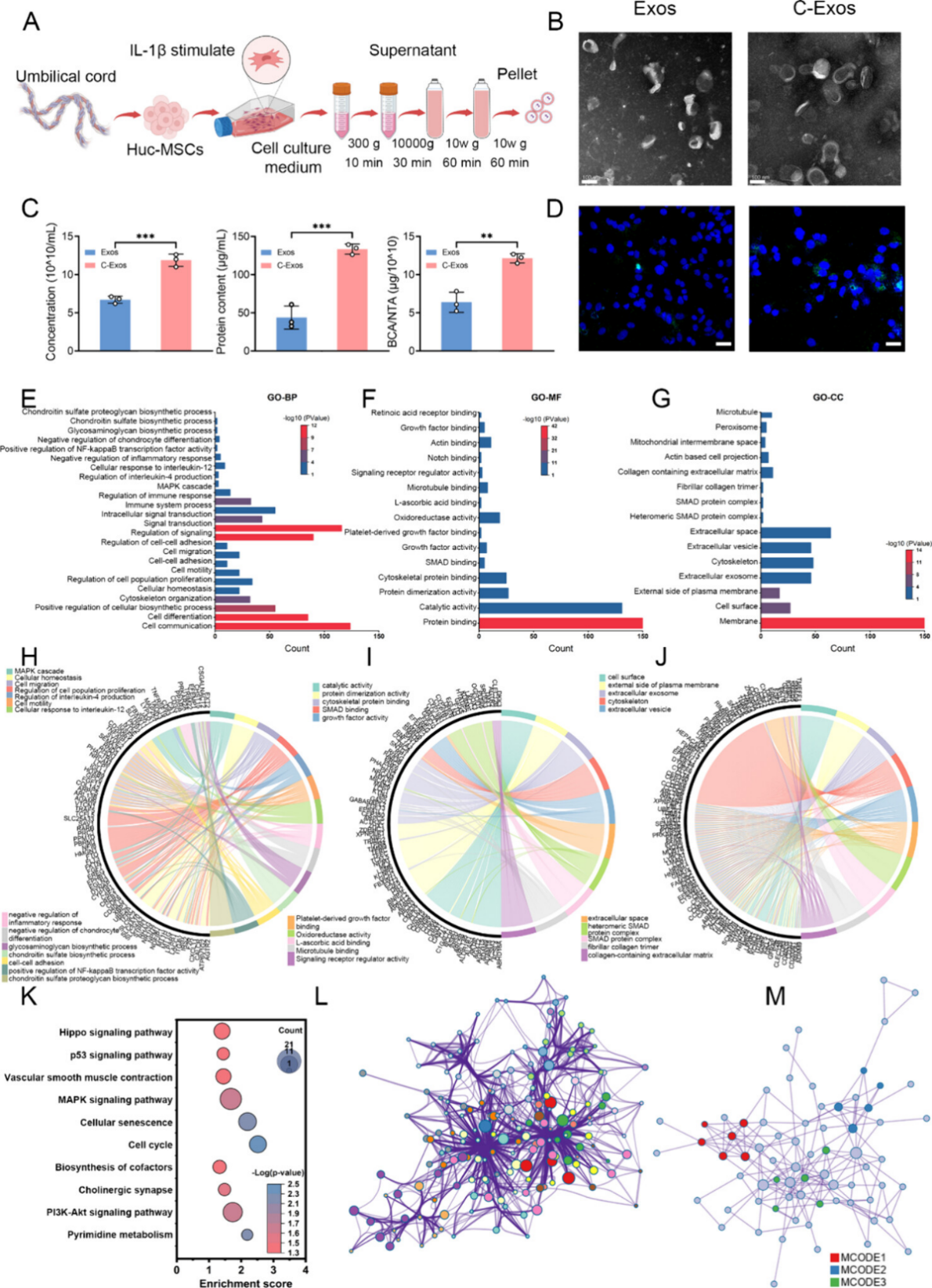
图2. C-Exos的鉴定和生物信息学分析
研究者鉴定了C-Exos中差异表达的miRNA,并分析了其相关靶基因通路,以推测其在OA治疗中的潜在机制(图2)。通过TargetScan和miRDB对显著上调的11个miRNA进行靶基因预测,并对预测的靶基因进行Gene Ontology(GO)富集分析,结果显示,这些差异表达的miRNA与细胞增殖、炎症免疫调节及软骨基质再生等生物学过程密切相关,其中在炎症免疫调节方面的作用尤为突出。
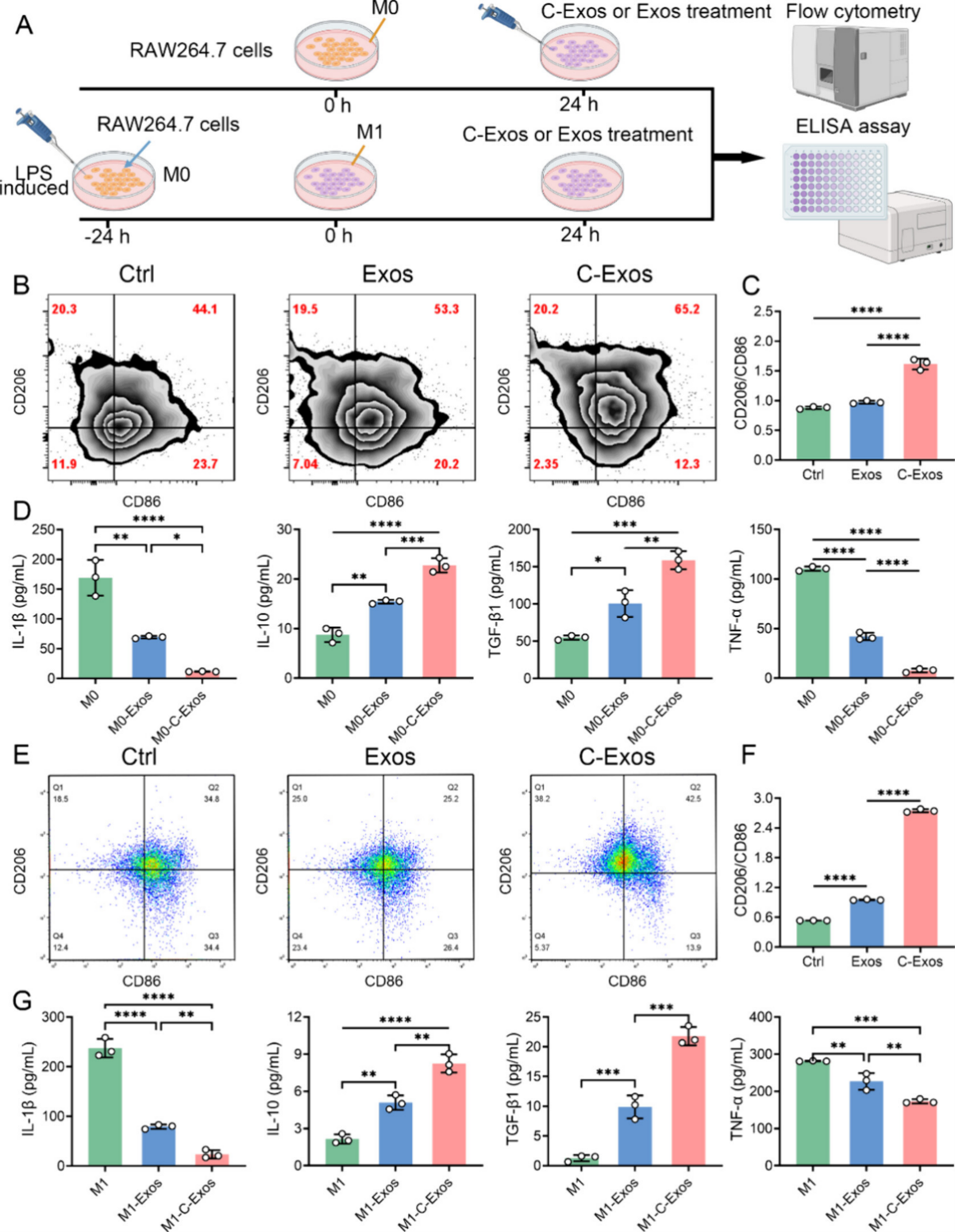
图3. C-Exos对巨噬细胞极化的影响
通过体外实验进一步验证了C-Exos在软骨基质再生和炎症免疫调节方面的积极作用。结果显示,C-Exos显著促进软骨细胞功能和软骨相关基质的分泌,同时促进M1型巨噬细胞向M2表型极化,改善炎症微环境,从而提升软骨损伤修复和炎症调节的潜力。
这项研究概述了一种针对OA治疗的创新策略,利用来自HucMSCs的功能性外泌体,以实现精准的炎症调节和软骨再生潜能。同时,该研究也为功能化C-Exos水凝胶微球作为一种具有前景的生物制剂提供了新思路,推动其在OA治疗中促进炎症调节的进一步临床转化研究。
参考文献:
Remodeling the Proinflammatory Microenvironment in Osteoarthritis through Interleukin-1 Beta Tailored Exosome Cargo for Inflammatory Regulation and Cartilage Regeneration, ACS Nano. 2025 Feb 4;19(4):4924-4941. doi: 10.1021/acsnano.4c16785. Epub 2025 Jan 23.
外泌体资讯网 ACS Nano|四川大学国家生物医学材料工程技术研究中心王启光/樊渝江:IL-1β定制化干细胞外泌体重塑与软骨修复策略