尽管近年来靶向治疗和免疫治疗取得显著进展,化疗仍是晚期非小细胞肺癌(NSCLC)患者的核心治疗手段。然而,绝大部分患者在化疗后出现获得性耐药,导致治疗失败和肿瘤复发,这成为临床治疗的重大挑战。研究表明,肿瘤干细胞(CSCs)在肿瘤耐药性和复发中起关键作用。CSCs具有自我更新、多向分化和耐药性等特性,即使经过高强度化疗,仍能通过动态调控表型可塑性(如从非CSCs状态重编程为CSCs状态)驱动肿瘤恶性进展。然而,CSCs如何维持耐药状态并自我更新的分子机制尚不明确。
近日,上海交通大学医学院附属胸科医院核医学科和上海健康医学院上海市分子影像学重点实验室的研究团队在《Theranostics》期刊(中科院一区,IF 12.4)上发表题为“A novel pathway for stemness propagation and chemoresistance in non-small cell lung cancer via phosphorylated PKM2-loaded small extracellular vesicles”的研究论文,发现CSCs通过分泌携带磷酸化PKM2蛋白的小细胞外囊泡(sEVs),调控受体细胞的能量代谢与细胞周期,从而驱动化疗耐药和肿瘤恶性进展。
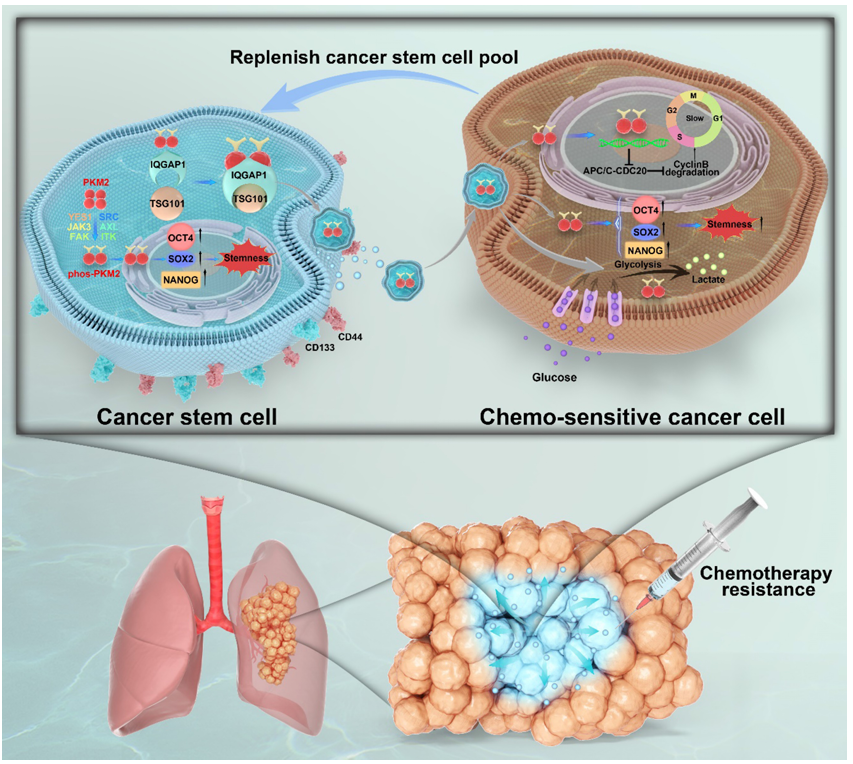
当肺癌患者化疗后病情反复,肿瘤细胞为何“死而复生”?耐药性如何从少数肿瘤干细胞扩散到整个肿瘤?肿瘤细胞如何在“普通状态”与“耐药状态”间自由切换?研究团队给出答案:CSCs通过sEVs向整个肿瘤生态系统发送“耐药指令”,而磷酸化PKM2蛋白就是指令的核心密码!研究团队锁定了一个关键角色——支架蛋白IQGAP1,它在CSCs中扮演“物流主管”,专门负责将磷酸化PKM2精准打包进sEVs,随后普通肿瘤细胞接收这些“致命快递”并触发连锁耐药反应。其主要的分子机制包括:
- sEVs作为耐药性传播的“特洛伊木马”:CSCs分泌的sEVs选择性富集磷酸化的PKM2(pY105-PKM2),通过抑制APC/CDC20复合体活性,阻滞受体细胞的细胞周期于G2/M期。这种“减速带”效应使普通癌细胞获得干细胞特性(CD133+/Oct4+),并显著增强对顺铂等化疗药物的抵抗能力。
- IQGAP1-PKM2轴的双重调控作用:支架蛋白IQGAP1与pY105-PKM2结合,介导其向sEVs的分选。临床数据显示,IQGAP1与pY105-PKM2在CD133高表达肿瘤中协同作用,可作为预后不良的联合生物标志物。
- 代谢-细胞周期-干性调控网络:sEVs传递的pY105-PKM2诱导受体细胞代谢重编程,表现为糖酵解通量增强和线粒体功能抑制,形成促肿瘤生长的酸性微环境。同时,细胞周期减速促进CSCs细胞休眠和干性基因表达,建立恶性循环。
这项研究首次将代谢重编程、细胞间通讯与干细胞特性动态调控三者结合,揭示了肺癌恶性进展的“能量-周期-耐药”轴,为未来探索靶向sEVs和PKM2磷酸化的临床转化方案、破解肺癌耐药难题提供了全新视角。
上海交通大学医学院附属胸科医院核医学科黄钢教授、谢文晖主任、上海健康医学院上海市分子影像学重点实验室杨浩副教授为本文共同通讯作者,博士研究生王靖怡和刘柳副主任为共同第一作者。本研究同时得到了休斯顿卫理公会研究所Alessandro Grattoni教授和Corrine Ying Xuan Chua教授的工作支持。
参考文献:Wang J, Liu L, Gao X, Liu X, Dai Y, Mao Z, Huang S, Li J, Wang D, Qi Y, Han Y, Xu Y, Chua CYX, Grattoni A, Xie W, Yang H, Huang G. A novel pathway for stemness propagation and chemoresistance in non-small cell lung cancer via phosphorylated PKM2-loaded small extracellular vesicles. Theranostics 2025; 15(8):3439-3461. doi:10.7150/thno.103722.
外泌体资讯网 Theranostics丨上海交通大学/上海健康医学院黄钢教授课题组揭示肺癌干细胞通过细胞外囊泡维持耐药的新机制





