肿瘤微环境存在多种细胞来源的细胞外囊泡(EVs),EVs的来源和表型分析有助于理解肿瘤生理过程中EVs在细胞间通信中的生物学作用。然而,传统方法通常通过酶解肿瘤组织碎片分离肿瘤组织中的EVs,不仅降低了肿瘤组织的活力,也忽视了肿瘤组织的空间架构和EVs分泌的动态特性。近日,厦门大学化学化工学院宋彦龄教授课题组在Anal. Chem.杂志上发表题为“Microfluidic Replication and Phenotypic Profiling of Extracellular Vesicles from the Tumor Microenvironment Using Dual-Switch Aptamer Logic Gates”的研究论文。 该研究团队建立了可培养完整肿瘤组织的微流控平台,可保持肿瘤组织的空间架构以及EVs的动态分泌。利用亲和捕获以双开关核酸适体逻辑门策略,实现了肿瘤组织中细胞分泌EVs的直接捕获以及高保真表型分析。此外,研究表明,使用PD-1抗体的免疫治疗显著增强了肿瘤微环境中免疫细胞EVs的分泌。该方法为研究EVs在肿瘤病理生理学中的生物功能及其意义提供了一个有力的工具。文章第一作者为福建医科大学附属第一医院创伤中心急诊外科吴巧艺主任医师,厦门大学化学化工学院吴秋月博士;通讯作者为厦门大学化学化工学院宋彦龄教授,海南大学环境科学与工程学院朱琳副教授。
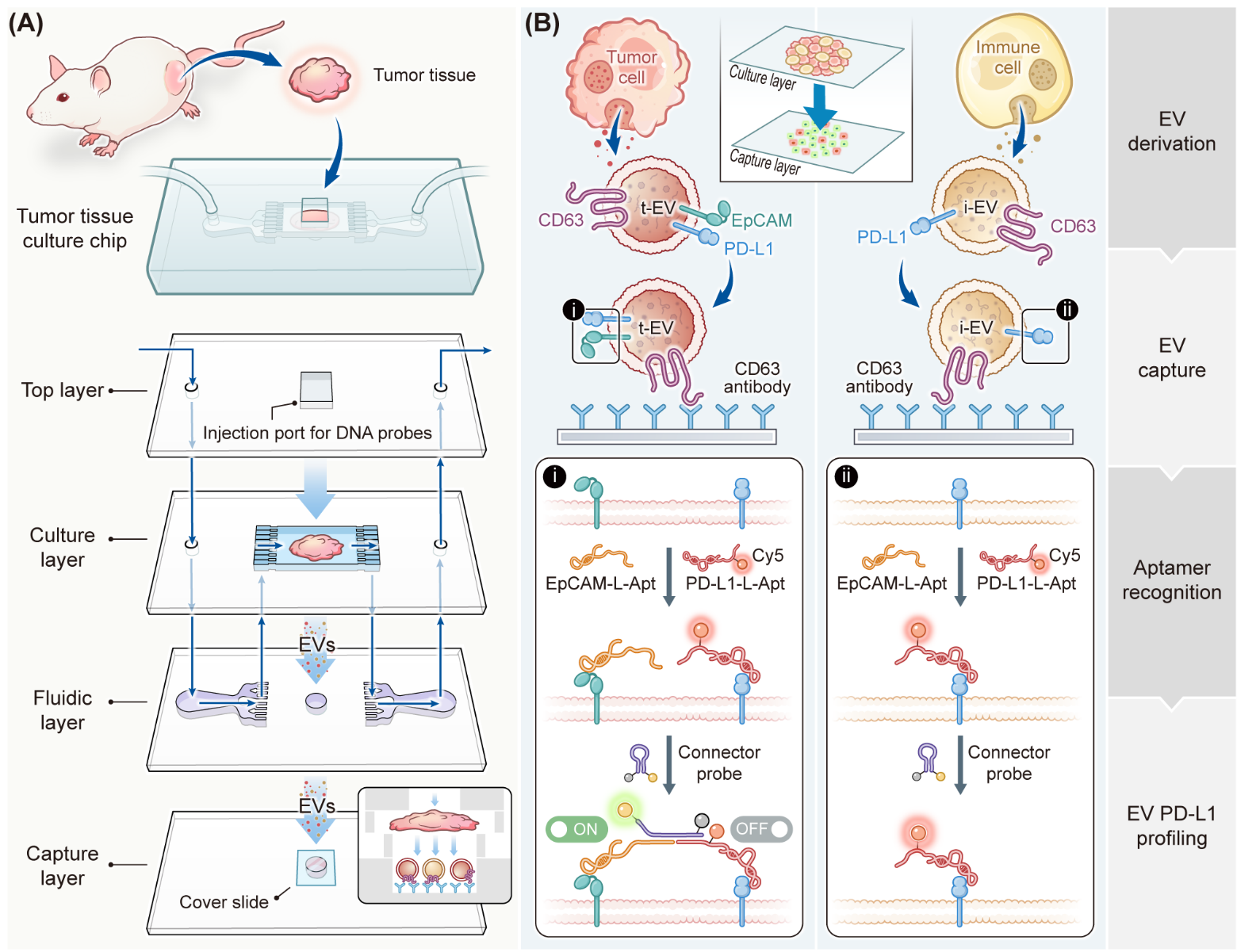
细胞外囊泡(EVs)可通过血液循环介导远距离细胞间通信,以及旁分泌效应等介导短距离细胞间通信,调节多种生理和病理过程。目前,从体液中分离分析电EVs的方法取得了诸多进展。然而,组织中EVs分离和分析的方法尚不完善。 一方面,传统方法主要依赖组织酶解以及差速超离心从肿瘤微环境中纯化EVs,该方法劳动密集型、收率低、纯度低的方法,并且忽略了组织的空间组织方式。将肿瘤组织酶为单细胞,并在微流控芯片中捕获和分析单细胞分泌EVs的方法,会降低细胞的活力,从而降低细胞的分泌EVs的效率。并且,分析单细胞分泌的EVs忽略了组织中细胞的相互作用以及空间架构。因此,亟需发展非侵入的、空间信息保存的肿瘤微环境中EVs分离方法。另一方面,EVs的标志物(核酸、蛋白质等)以及来源具有显著的异质性,测定不同细胞分泌的总EVs对肿瘤的诊断和预后预测的临床指导意义有限。因此,亟需发展生理性肿瘤组织EVs分离以及亚群分析方法,并探究异质性EVs参与肿瘤进展的生物学机制。该研究通过使用微流控芯片将肿瘤组织中细胞分泌的EVs捕获到芯片中,并采用组合适体诱导的双开关逻辑门策略,分析肿瘤组织中表达PD-L1的EVs的来源(肿瘤细胞以及免疫细胞),从而实现肿瘤微环境中EVs来源的精准分析(原理图1)。在完整的肿瘤组织于微流控芯片中,微流控芯片包括:用于注射DNA探针的顶层,支持肿瘤生长的培养层,可降低流体剪切应力的流体层,以及修饰有EVs特异性捕获抗体CD63的捕获层。该芯片维持了肿瘤的生理状态,并能实时捕获肿瘤细胞分泌的EVs。基于肿瘤细胞来源EV(tEVs、PD-L1+和EpCAM+)与免疫细胞源性EVs (iEVs、PD-L1+和EpCAM−)表面生物标志物的表达差异,设计中间序列修饰Cy5荧光的PD-L1蛋白识别适体Cy5-PD-L1-L、EpCAM蛋白识别适体EpCAM-L以及分子信标Connector(两端各修饰荧光分子FAM以及淬灭基团BHQ)。tEVs可同时结合Cy5-PD-L1-L以及EpCAM-L,两者的延伸连与Connector互补配对,打开Connector发卡结构,Connector的FAM荧光恢复。同时,Connector的淬灭基团BHQ与Cy5- PD-L1-L适体的Cy5荧光邻近,将Cy5的荧光淬灭,由此产生FAM荧光恢复,Cy5荧光淬灭的双开关信号响应模式。免疫细胞为PD-L1+,EpCAM−,只能与Cy5-PD-L1-L适体结合,难以打开Connector,无法产生此信号响应。因此,该方法可精准分析表达PD-L1的EVs的来源。
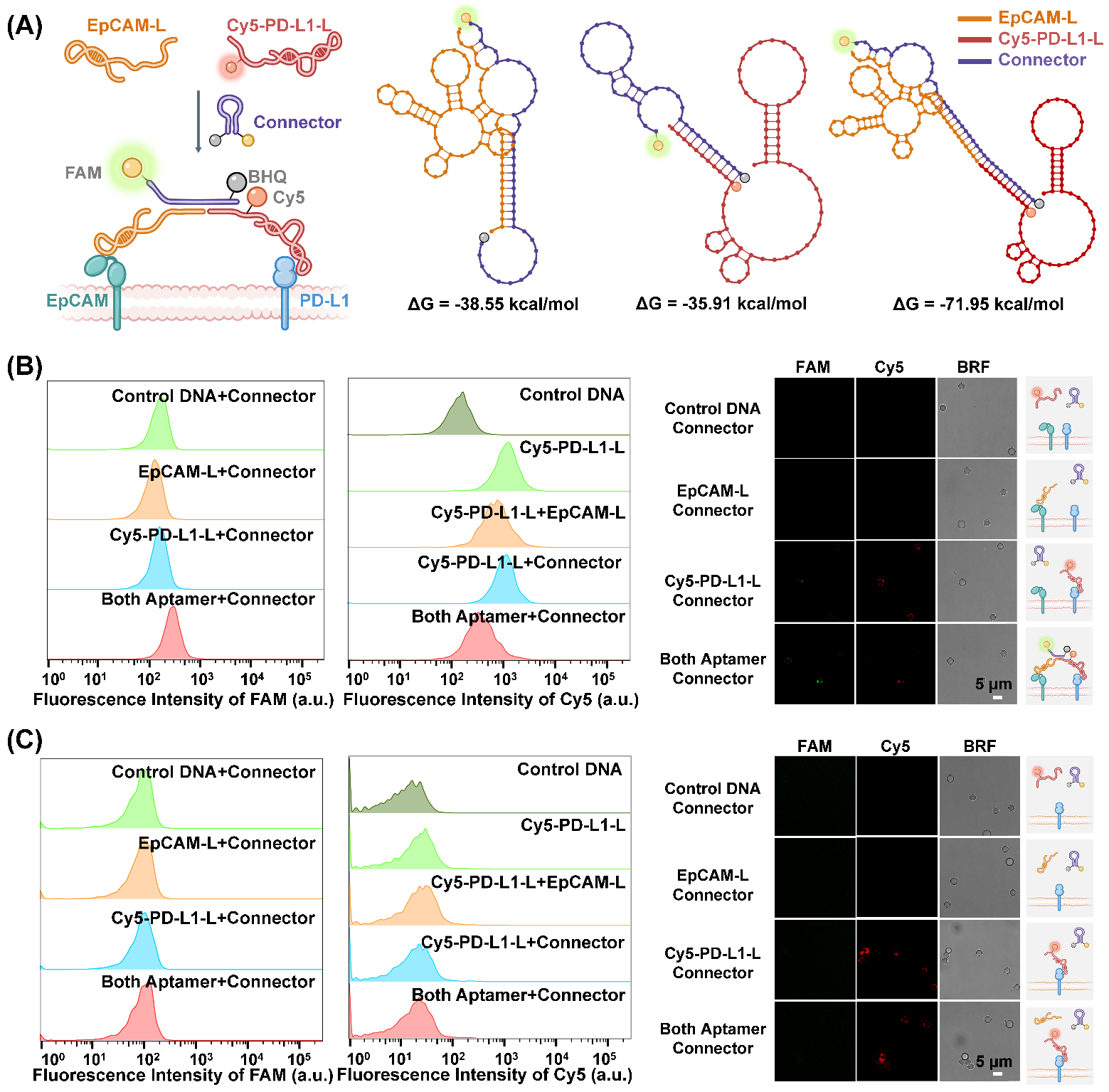
肿瘤微环境中EVs表型鉴定原理图对互补配对的DNA探针的吉布斯自由能计算结果表明,相对于Cy5-PD-L1-L与Connector互补配对以及EpCAM-L与Connector互补配对,Cy5-PD-L1-L、EpCAM-L以及Connector同时互补配对后的DNA探针稳定性最佳(图1A),因此,Cy5-PD-L1-L与EpCAM-L同时存在时,最容易将Connector的发卡结构打开,产生双开关信号。流式细胞术以及激光共聚焦显微镜成像结果表明,相对于对照组,肿瘤细胞来源模式细胞外囊泡EVA375同时与Cy5-PD-L1-L、EpCAM-L、Connector孵育时,产生FAM荧光恢复、Cy5荧光淬灭的双开关信号响应(图1B)。而免疫细胞来源模式细胞外囊泡EVU251无此信号响应(图1C)。因此,该策略在缓冲液体系具有可行性。
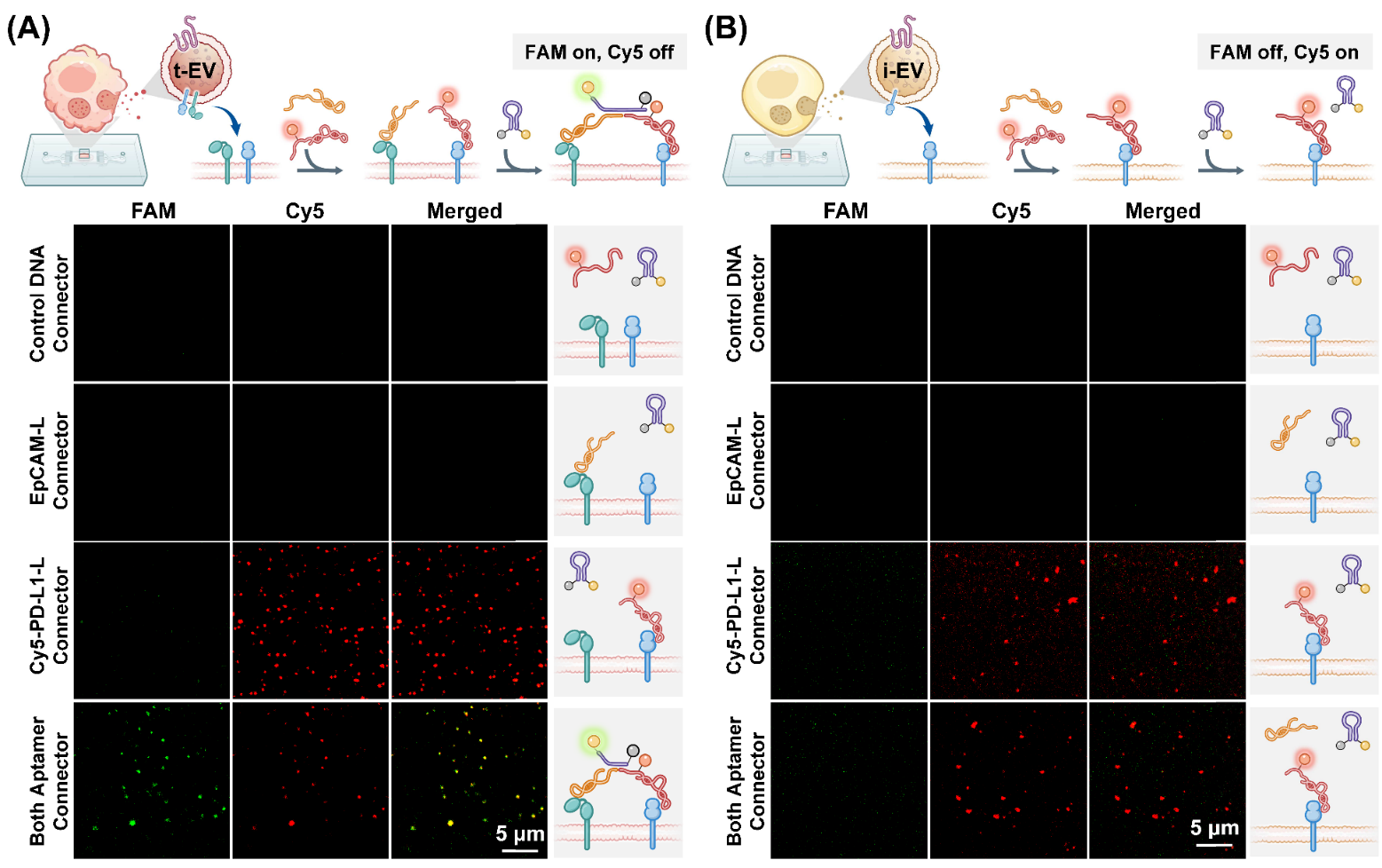
使用芯片捕获EVA375以及EVU251,并考察双开关策略鉴定两种EVs的可行性。结果表明,相对于对照组,EVA375与Cy5-PD-L1-L、EpCAM-L、Connector同时孵育时可产生双开关信号,而EVU251无此信号响应。因此,适体诱导的双开关逻辑门策略可用于芯片捕获tEVs和iEVs的差异鉴定。
图2. 微流控芯片中EVs的捕获及表型鉴定由于肿瘤组织中多种细胞均可分泌EVs,因此需要鉴定使用芯片捕获以及鉴定混合EVs的性能。将EVA375以及EVU251以不同比例混合,使用芯片捕获以及DNA探针鉴定。结果表明,随着EVU251比例的增加,芯片表面每个颗粒的Cy5/FAM的荧光强度呈增加趋势(图3,R2 = 0.95)。因此,该方法可用于微流控芯片中不同细胞来源EVs的鉴定。
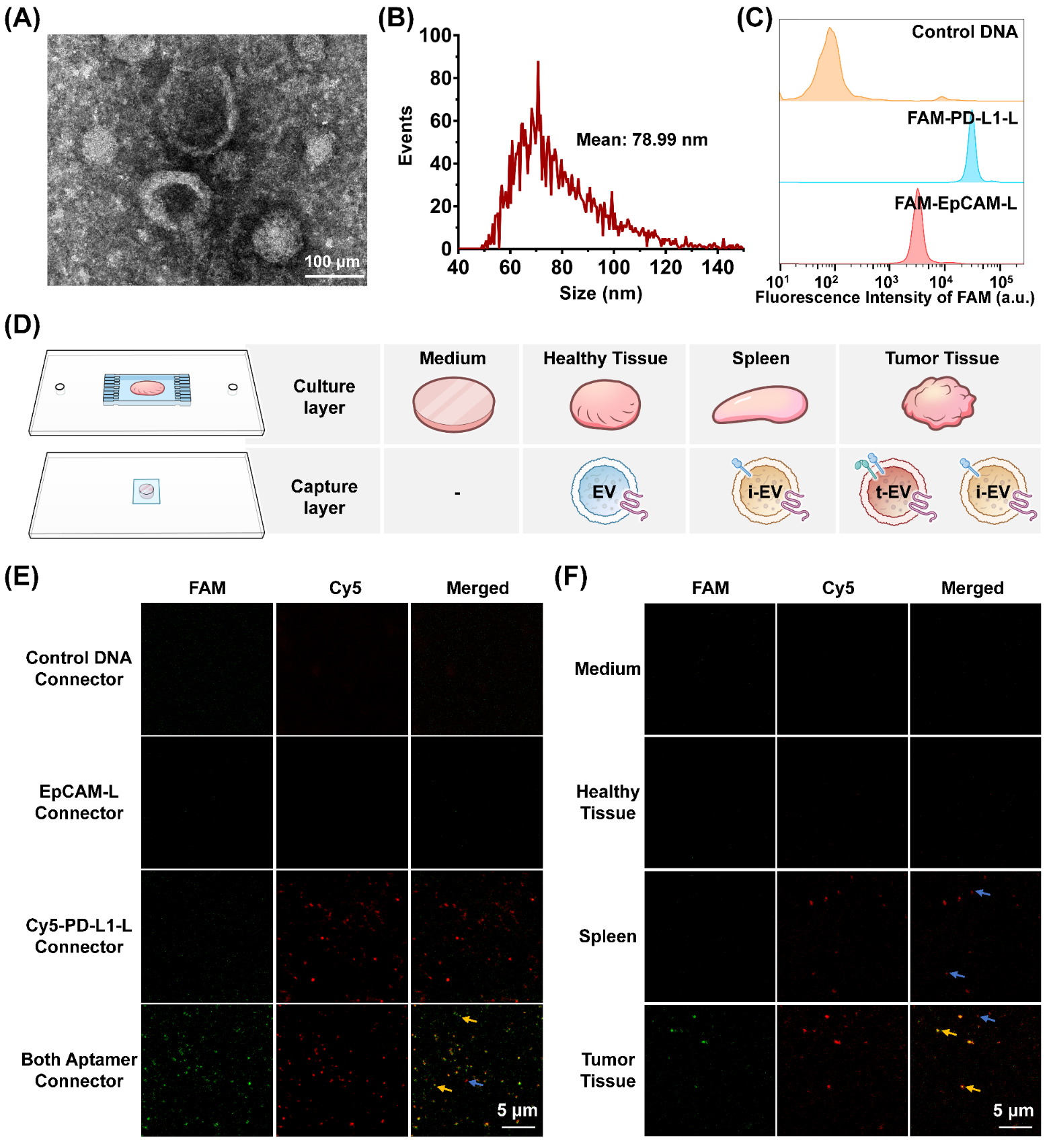
图3. 微流控芯片中混合EVs的鉴定为考察该方法用于鉴定肿瘤微环境中不同来源EVs的可行性,建立了乳腺癌4T1细胞皮下移植瘤模型。取肿瘤组织于芯片中培养,通过超速离心法纯化组织分泌的EVs。通过透射电子显微镜拍摄所得颗粒为杯状(图4A),使用纳米粒径分析仪统计所得颗粒平均粒径为78.99 nm(图4B),均符合EVs的物理特征。流式细胞数分析结果表明,肿瘤组织分泌的颗粒呈PD-L1+、EpCAM-L+(图4C)。因此4T1细胞皮下移植肿瘤可分泌PD-L1+、EpCAM-L+的EVs,用作肿瘤微环境中EVs表型分析模型。接着,对不同组织中的EVs进行鉴定,考察该方法用于肿瘤微环境中EVs鉴定的可行性(图4D)。在芯片中培养肿瘤组织,使用DNA探针对捕获的EVs染色(图4E),结果表明,仅当同时使用EpCAM-L、Cy5-PD-L1-L和Connector染色时,出现Connector+, Cy5-PD-L1-L- 的EVs(tEVs)以及Connector-, Cy5-PD-L1-L+的EVs(iEVs)。此外,脾脏分泌的EVs仅为iEVs(Connector-, Cy5-PD-L1-L+),健康组织以及培养基中为检出EVs(图4F)。上述结果表明,双开关适体逻辑门策略可用于肿瘤微环境中EVs的表型鉴定,并且具有特异性。
图4. 4T1肿瘤组织中EVs的表型分析最后,采用发展的方法考察PD-1抗体免疫治疗对肿瘤微环境中EVs分泌的影响。对4T1荷瘤小鼠给予不同剂量的PD-1抗体进行免疫治疗,结果表明,免疫治疗的疗效呈PD-1抗体剂量依赖性(图5A)。取肿瘤组织在芯片中培养,鉴定组织中细胞分泌的tEVs以及iEVs(图5B)。结果表明,随着肿瘤组织体积的减小,肿瘤组织中Cy5/FAM/颗粒的荧光强度增强(R2 = 0.9932,图5C)。此外,肿瘤组织CD68/EpCAM荧光值(巨噬细胞/肿瘤细胞)与Cy5/FAM/颗粒有较好的线性关系(R2 = 0.9571,图5C)。上述结果可能是由于PD-L1/PD-1轴对肿瘤微环境中免疫细胞的具有抑制作用,而抗PD-1抗体恢复了免疫细胞的功能,增加了iEVs的分泌。这些发现表明了本研究所提出的策略具有作为肿瘤疗效预测工具的潜力。

图5. PD-1抗体免疫治疗对肿瘤微环境中EVs分泌的影响总之,该项研究提出一种组合适体诱导的双开关逻辑门方法,用于肿瘤微环境中EVs的表型分析。利用该策略,在微流控芯片中实现了肿瘤组织中分泌的EVs的表型分析,并表明PD-1抗体免疫疗法可促进免疫细胞来源EVs的分泌。可用于个性化抗肿瘤药物筛选和治疗效果评估。采用廉价的材料,如PMMA、PC等用于微流控芯片制作,结合低成本的DNA探针用于检测,降低了使用成本,提高了在临床应用的可及性。参考文献:Microfluidic Replication and Phenotypic Profiling of Extracellular Vesicles from the Tumor Microenvironment Using Dual-Switch Aptamer Logic Gates. Anal Chem. 2025 Feb 26. doi: 10.1021/acs.analchem.5c00234.
外泌体资讯网 Anal Chem|厦门大学宋彦龄/海南大学朱琳:基于双开关适体逻辑门的肿瘤微环境中细胞外囊泡的微流控复制与表型分析