胶质母细胞瘤(Glioblastoma multiforme, GBM)作为成人中枢神经系统最具侵袭性的原发性恶性肿瘤,其临床治疗面临严峻挑战。尽管采用最大安全切除联合放化疗的综合治疗方案,患者中位生存期仍不足2年,且五年生存率仅5.8%,肿瘤复发率高达90%以上。这一现状凸显了突破传统治疗范式、开发新型精准疗法的迫切需求。
针对上述难题,空军军医大学西京医院林伟教授团队在Journal of Nanobiotechnology杂志上发表题为“Synergistic strategies for glioblastoma treatment: CRISPR-based multigene editing combined with immune checkpoint blockade”的研究成果,构建了一种工程化多功能细胞外囊泡(AP-sgPV-EV)递送系统,首次在单一平台实现免疫检查点阻断与多基因编辑的协同增效。
该研究通过三大创新设计为GBM治疗提供了"一体化"解决方案:
- 智能递送系统构建:通过基因工程技术在细胞外囊泡表面共表达PD-1受体与脑靶向多肽Angiopep-2(Ang2),巧妙利用血脑屏障及胶质瘤细胞高表达的低密度脂蛋白受体相关蛋白(LRP)实现精准靶向。
- 免疫微环境重塑:工程化囊泡通过表面PD-1与肿瘤细胞PD-L1的竞争性结合,有效逆转T细胞耗竭状态。实验数据显示,治疗后肿瘤微环境中CD8+效应T细胞比例显著提升,而髓源性抑制细胞(MDSCs)和M2型巨噬细胞比例显著下降,标志着免疫抑制微环境向抗肿瘤表型的转化。
- CRISPR/Cas9多基因协同编辑:通过共载靶向PLK1和VEGF基因的sgRNA/Cas9复合物,该体系在体内实现双基因同步编辑(PLK1: 58.6%;VEGF: 52.7%),诱导肿瘤细胞周期阻滞及凋亡,同时抑制肿瘤血管生成。
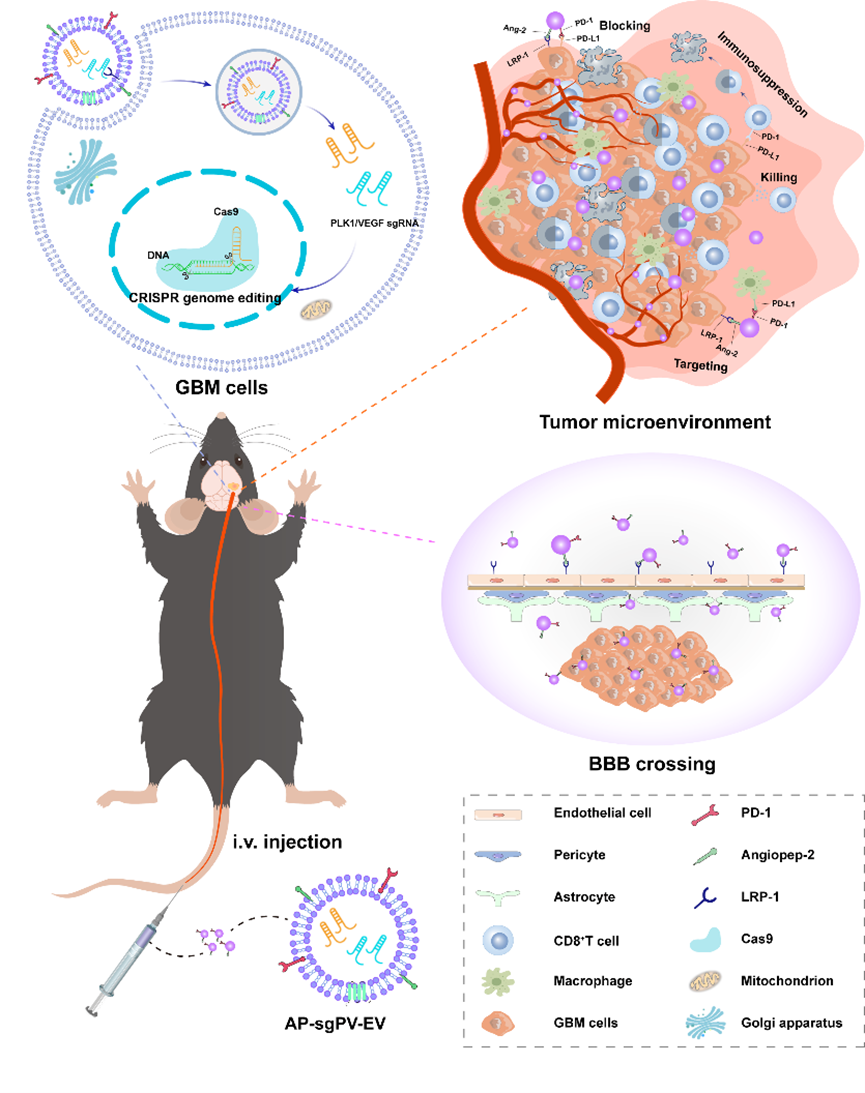
图1 工程化细胞外囊泡作用机制示意图
该方案通过精准靶向,构成针对GBM增殖、血管生成和免疫逃逸的立体化打击网络(图1),显著延长荷瘤小鼠生存期,为脑肿瘤的精准治疗开辟了新维度,展现出了广阔的应用前景和巨大的发展潜力。
参考文献:Synergistic strategies for glioblastoma treatment: CRISPR-based multigene editing combined with immune checkpoint blockade.J Nanobiotechnology. 2025;23(1):94. Published 2025 Feb 7. doi:10.1186/s12951-025-03112-8
外泌体资讯网 J Nanobiotechnology|西京医院林伟:胶质母细胞瘤治疗的协同策略:基于CRISPR的多基因编辑结合免疫检查点阻断





