癌症是全球范围内导致死亡的主要原因之一,早期诊断对提高患者生存率至关重要。尽管近年来肿瘤诊断技术不断发展,但现有方法多针对单一癌种,且严重依赖实验室检查与影像学技术的结合。因此,迫切需要开发一种无创、快速且经济高效的泛癌筛查手段。外泌体作为细胞间通讯的重要媒介,富含RNA等生物信息,被认为是理想的非侵入性生物标志物来源。然而,目前针对泛癌外泌体RNA特征的系统性筛选方法尚不完善,相应的临床诊断模型亦未得到有效开发。近日,广西医科大学王富博教授团队在Molecular Cancer期刊发表了题为"Identification of Blood-derived Exosomal Tumor RNA Signatures as Noninvasive Diagnostic Biomarkers for Multi-Cancer: A Multi-Phase, Multi-Center Study"的研究论文(DOI: 10.1186/s12943-025-02271-4)。该研究采用多中心、多阶段研究策略,结合血浆来源的外泌体、RNA特征生物标志物及机器学习技术,基于8种常见肿瘤共计2,203例样本,构建了一种创新性的泛癌诊断模型,为癌症的早期筛查和精准定位提供了有力工具。文章第一作者为王富博教授、王承邦、陈少华、韦春梦、吉进和刘燕,通讯作者为王富博教授、莫曾南教授、徐斌教授、程继文教授、汪珍光教授和欧阳柳教授。
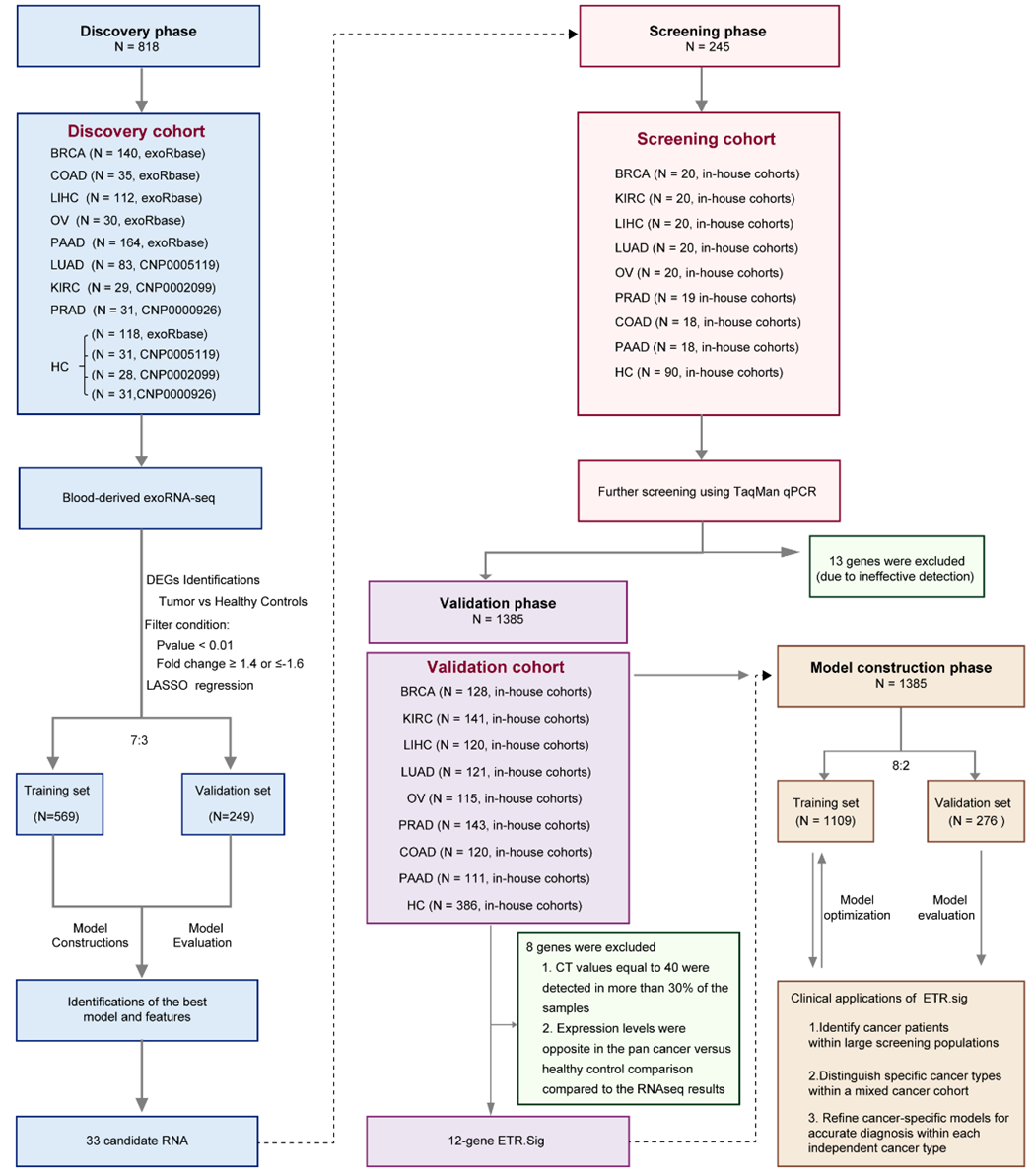
该研究分为发现、筛选、验证和模型构建四个阶段(图1)。在发现阶段(Discovery phase),研究人员对BRCA、COAD、LIHC、OV、PAAD、LUAD、KIRC和PRAD的患者及健康对照者的血液样本中外泌体RNA表达谱进行分析,通过外泌体RNA测序数据初步筛选出一批候选生物标志物。在筛选阶段(Screening phase),利用来自多个独立中心的样本,采用TaqMan qPCR技术对候选指标进行进一步验证,并剔除检测可靠性较低的部分标志物,以确保后续工作的准确性。在验证阶段(Validation phase),研究队列规模进一步扩大,通过严格的排除标准(例如剔除在多数样本中检测不到或表达模式与RNA测序数据不一致的指标),最终确定出一组关键生物标志物,并命名为ETR.sig。在模型构建阶段(Model construction phase),研究团队将筛选得到的关键生物标志物ETR.sig纳入模型构建。
图1 研究流程图构建的诊断模型在区分癌症与健康对照方面表现出色,其AUC值高达约0.915。在多分类模型中,针对八种不同癌症类型,宏平均和微平均AUC分别达到约0.983和0.985,显示出极强的分类能力。此外,各肿瘤类型(包括乳腺癌、结肠癌、肝癌、卵巢癌、胰腺癌、肺癌、肾癌和前列腺癌)的诊断模型均获得了较高的AUC值,进一步印证了模型在多癌种早期筛查中的高性能和临床实用性(图2),研究还利用TCGA数据探讨了候选生物标志物与临床特征之间的相关性,并通过单细胞转录组数据初步解析了其潜在的细胞来源。
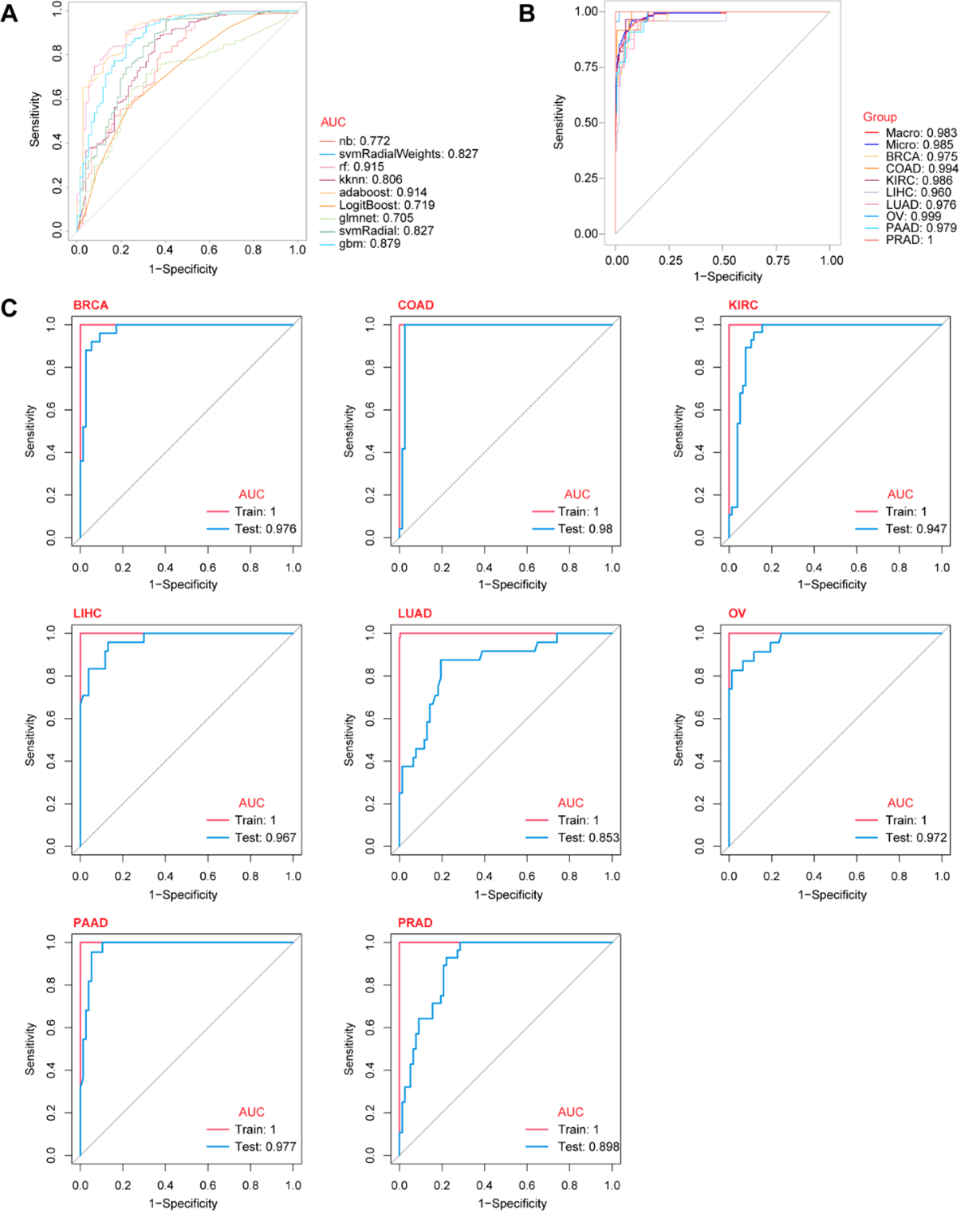
图2 构建基于TaqMan qPCR的血源性exoRNA诊断模型总之,该研究基于对血液来源外泌体RNA生物标志物的全方位探索,成功筛选并验证出一组全新的多癌症生物标志物——ETR.sig。该标志物在癌症检测和肿瘤起源判定方面均展现出卓越的诊断准确性,为实现微创、快速且可重复的癌症筛查提供了有力工具。虽然研究初步揭示了外泌体衍生RNA特征在反映肿瘤生物学方面的潜力,但外泌体介导的细胞间通讯机制仍需进一步阐明。随着后续研究的深入,ETR.sig有望成为多癌症早期诊断的新突破,为精准癌症管理开辟全新的方向!参考文献:Identifcation ofblood-derived exosomal tumor RNA signatures as noninvasive diagnostic biomarkers for multi-cancer: a multi-phase, multi-center study. Molecular Cancer (2025) 24:60. https://doi.org/10.1186/s12943-025-02271-4.
外泌体资讯网 Mol Cancer| 广西医科大学王富博:多中心、多阶段研究鉴定血源性外泌体肿瘤RNA特征作为多种癌症的无创诊断生物标志物