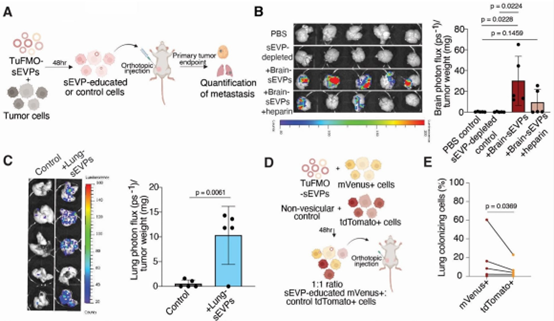
癌症转移是恶性肿瘤治疗中最具挑战性的难题之一。乳腺癌转移至脑部、肺部等远处器官可显著降低患者的生存率。近年来,科学家们逐渐认识到,肿瘤细胞在转移过程中并非“孤军奋战”,而是通过与远处器官的“对话”来准备适合自身存活的微环境——即“转移前微环境”。这种微环境的形成可能与肿瘤细胞释放的细胞外囊泡(Extracellular Vesicles, EVs)密切相关。近日,来自德国海德堡癌症研究中心DKFZ等机构的一项研究显示,来自无肿瘤的转移前器官来源的小型细胞外囊泡(TuFMO-sEVPs)在乳腺癌转移中发挥关键作用,并提出了潜在的治疗策略。相关内容以“Small extracellular vesicles and particles (sEVPs) derived from tumor-free pre-metastatic organs promote breast cancer metastasis and support organotropism”为题在线发表于3月8日的国际知名肿瘤学学术期刊Molecular Cancer杂志上。
肿瘤转移是一个复杂到令人望而生畏的过程,仍然是实体癌(包括乳腺癌)治疗的主要障碍。转移性乳腺癌(MBC)发生在原发肿瘤扩散出先锋细胞(pioneer cells),这些细胞通过血液或淋巴系统转移到远处器官(如大脑、肺部、骨头和肝脏),形成新的肿瘤病灶。值得注意的是,细胞间通信是这一多阶段过程的一个关键特征。除了原发肿瘤微环境内的局部通信外,癌细胞还可以长距离向未来转移的部位发出信号,诱导形成一个被称为转移前生态位(pre-metastatic niche, PMN)的友好微环境。这种转移前生态位在迁移的肿瘤细胞到达对应部位后,促进其存活和增殖。尽管如此,细胞外囊泡和颗粒(extracellular vesicles and particles,EVPs)已被证明是细胞间通信(局部和全身范围内)的关键介质。EVPs是一组异质性膜结合囊泡的总称,其中包括直径通常小于200 nm的小细胞外囊泡和颗粒(sEVPs)。sEVPs由大多数(如果不是全部)正常和癌细胞分泌,包含多种生物活性分子,包括核酸、蛋白质、代谢物和脂质。一旦从供体细胞中释放,sEVPs可以将功能载物传递给邻近或远处的受体细胞,影响它们的表型和功能。在癌症中,sEVP通过双向通信在肿瘤微环境中发生作用,涉及良性和恶性细胞。具体来说,肿瘤来源的sEVPs已被证明在重塑宿主组织和促进癌症进展方面发挥多效作用。它们还通过增强血管生成、细胞外基质重塑和免疫调节来推动转移前生态位的形成。除了肿瘤来源的sEVPs外,肿瘤微环境中即刻的细胞成分——上皮细胞、癌相关成纤维细胞(CAFs)、脂肪细胞、内皮细胞和免疫细胞——也释放sEVPs,通过调节肿瘤细胞增殖和转移来支持癌症进展。值得注意的是,肿瘤来源和非肿瘤来源的sEVPs都可能成为新型生物标志物,因为它们在体液中广泛分布,并包含可用于识别其来源细胞的特定内容。尽管如此,来自正常组织(包括乳腺癌中无肿瘤的转移前部位,例如大脑和肺部)的sEVPs的功能仍未得到充分表征。尽管大脑和肺部来源的sEVPs在正常组织稳态和大脑或肺部相关疾病中已知发挥关键作用,但目前对这些sEVPs对肿瘤细胞的影响知之甚少,尤其是在乳腺癌转移过程中肿瘤细胞扩散和生长的背景下。这凸显了揭示无肿瘤部位的转移前器官来源的sEVPs(即TuFMO-sEVPs)的潜在功能的重要性,以便更好地理解和治疗转移性疾病。在这项研究中,研究人员提供了关于大脑和肺部TuFMO-sEVPs在促进乳腺癌转移的功能性证据,并可能对未来临床应用产生潜在影响。研究思路与内容1. 分离与表征sEVPs研究团队从肿瘤未侵袭过的“转移前器官”(如大脑和肺部)中分离出小型细胞外囊泡(sEVPs),即TuFMO-sEVP,并利用体内乳腺癌模型验证了这些sEVPs的特性。通过与不同类型的乳腺癌细胞相互作用,他们发现sEVPs能够被癌细胞摄取,并赋予其在特定器官中生存和增殖的能力。2. 癌细胞的“教育”与转移部位的选择sEVPs通过调节癌细胞的蛋白质表达谱,帮助癌细胞适应特定器官的环境。例如,来自大脑的sEVPs促进了与脑转移相关的蛋白质(如脂肪酸氧化和突触组织相关蛋白)的富集;而来自肺部的sEVPs则增强了与肺转移相关的IL6/STAT3信号通路的活性。这些发现表明,sEVPs通过“教育”肿瘤细胞,使其具备适应特定器官微环境的能力。3. DHFR在转移中的关键作用研究团队进一步发现,sEVPs的促转移作用依赖于一种关键酶——二氢叶酸还原酶(DHFR),该酶在DNA合成和快速增殖细胞的能量代谢中起着重要作用。通过FDA批准的抗寄生虫药物吡美梅(Pyrimethamine)抑制DHFR活性,可显著阻碍乳腺癌的转移。4. 器官特异性分子特征与患者预后研究人员还发现,sEVPs诱导的癌细胞具有器官特异性的蛋白质特征。这些特征在乳腺癌转移患者的肿瘤样本中得到了验证,并与患者的不良预后显著相关。5. 体内实验验证转移增强在免疫缺陷和免疫健全的小鼠模型中,研究团队发现,预先用大脑或肺部来源的sEVPs处理的乳腺癌细胞在转移至相应器官时表现出显著增强的转移能力。这表明sEVPs的作用并不依赖于适应性免疫系统,而是通过直接的代谢和信号通路调控机制发挥作用。研究意义与突破这项研究首次揭示了来自肿瘤未涉及的“转移前器官”的sEVPs在乳腺癌转移中的关键作用,阐明了癌症转移的“器官选择性”机制。研究不仅为理解癌症转移提供了新的视角,还为开发针对这一过程的治疗策略提供了潜在的靶点。例如,通过抑制DHFR活性或干扰sEVPs的功能,可能能够有效阻断乳腺癌的转移。研究团队认为,未来的研究将致力于探索sEVPs在其他癌症类型中的作用,并进一步验证DHFR抑制剂在临床治疗中的潜力。此外,研究还计划深入解析sEVPs的其他分子机制,以期开发更精准的抗癌疗法。参考文献: Small extracellular vesicles and particles (sEVPs) derived from tumor-free pre-metastatic organs promote breast cancer metastasis and support organotropism. Mol Cancer. 2025 Mar 8;24(1):72.