在癌症诊断领域,外泌体miRNA正逐渐成为揭示癌症奥秘的关键“密码”。大量研究表明,外泌体miRNA通过调控关键基因,成为肿瘤细胞增殖、转移及耐药形成的“幕后推手”,其表达水平与癌症分期显著相关。当前广泛应用的RT-qPCR技术虽然能提供较高的灵敏度,但其高度依赖精密设备、操作复杂,限制了其在即时检测中的应用。临床亟需一种兼具高灵敏度与操作简便性的检测方法,以突破现有技术瓶颈,为癌症的早期诊断和动态监测开辟新路径。南京大学生命科学学院、医药生物技术全国重点实验室的项阳教授课题组开发了一种基于工程化DNA纳米结构的三重放大策略电化学传感器,为无酶、高灵敏度的外泌体miRNA检测提供了新的方案。该传感器巧妙结合了级联toehold介导的链置换反应(CTSDR)、DNA四面体支持的杂交链式反应(TDN-HCR)和生物素-链霉亲和素放大技术,成功地实现了高效的miRNA检测。研究成果以“Enzyme-Free and Triple Sensitivity Amplification for Electrochemical Detection of Exosomal microRNA”为题发表在国际著名期刊Anal Chem上(2025 97(9):5244-5250)。南京大学博士研究生程文婷为论文的第一作者,南京大学项阳教授和南京医科大学第一附属医院王忠云主任为论文的共同通讯作者。
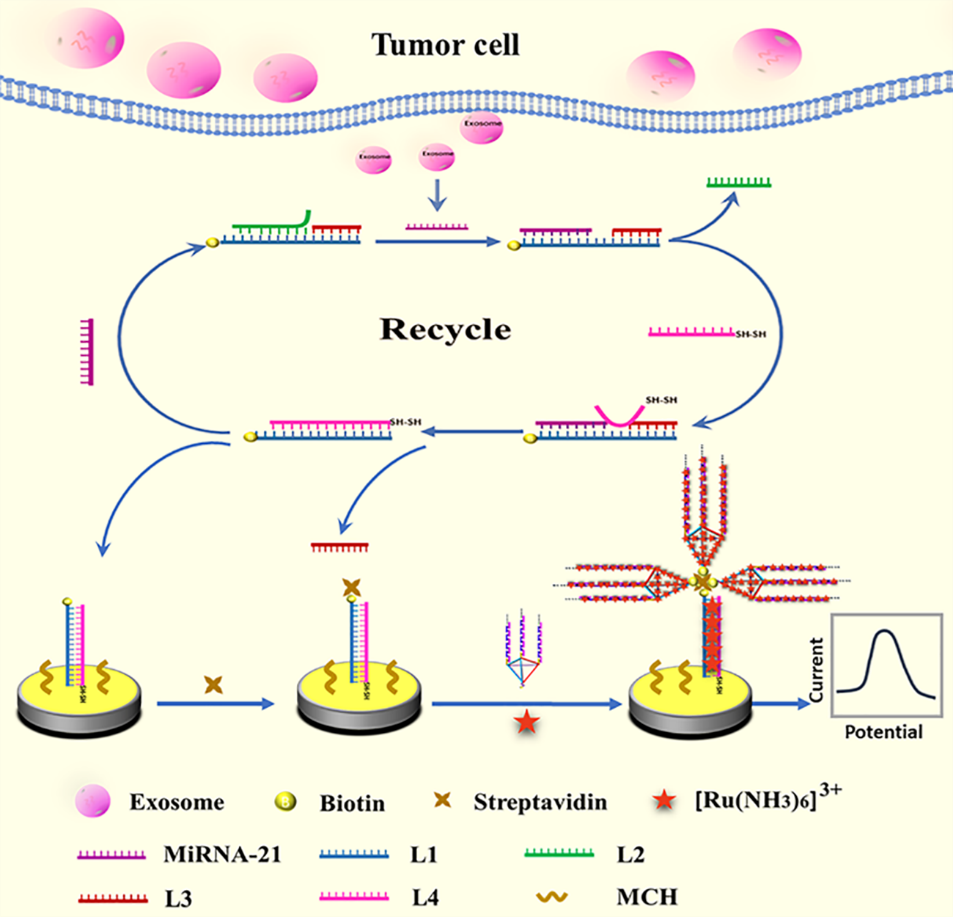
在这项研究中,如图1所示。整个检测流程包括三个关键步骤:(1)生物素化模板探针DNA L1与辅助探针DNA L2和L3通过退火形成双链DNA。在该dsDNA中,DNA L1的3’末端和中间区域分别包含两个toehold区域。当miRNA-21存在时,它与DNA L1的3’toehold区域结合,导致DNA L2从dsDNA中释放(第一次TSDR)。这一相互作用推动了新的双链DNA的形成,并暴露出DNA L1中的中间toehold区域。接着,暴露的中间toehold区域与巯基修饰的DNA探针L4结合,触发miRNA-21与DNA L3的释放(第二次TSDR)。释放的miRNA-21进一步引发新的循环过程,从而驱动目标miRNA-21的连续置换。这种反应的连续循环显著增加了生物素化和巯基修饰的双链DNA的数量。(2)将生物素化和巯基修饰的双链DNA通过金-硫键固定到金电极表面。接着,通过2-巯基乙醇(MCH)在电极表面形成致密单分子层,有效屏蔽非特异性吸附位点,同时调控探针分子空间取向。最后,借助链霉亲和素与生物素间超高亲和力,在界面精准构建生物素-链霉亲和素分子桥,为后续信号放大体系搭建稳定的生物识别基底。(3)基于生物素-链霉亲和素分子识别系统,生物素化TDN-HCR探针精准锚定于链霉亲和素功能化双链DNA界面。在此过程中,电化学指示剂RuHex通过静电作用锚定于DNA磷酸骨架,结合TDN三维四面体框架的有序纳米环境,实现RuHex分子在金电极表面的空间可控富集。RuHex能够与电极表面发生反应,通过电子转移产生显著的电化学信号。
图1.基于三重信号放大的无酶电化学生物传感检测外泌体miRNA的原理示意图。
经过可行性验证,如图2所示,该传感器能够有效检测乳腺癌细胞MCF-7来源外泌体中miR-21含量的变化,且检测限低至0.43 fM。进一步通过临床血清标本验证,乳腺癌患者外泌体中miR-21的表达水平与健康对照组相比存在显著差异,表明该传感器在临床应用中具有较大的潜力。与传统方法相比,该传感器不依赖酶催化,具有更高的灵敏度、更宽的线性范围和更低的检测限。同时,它简化了操作步骤,降低了成本,并展现出优异的稳定性,具备实际应用前景。
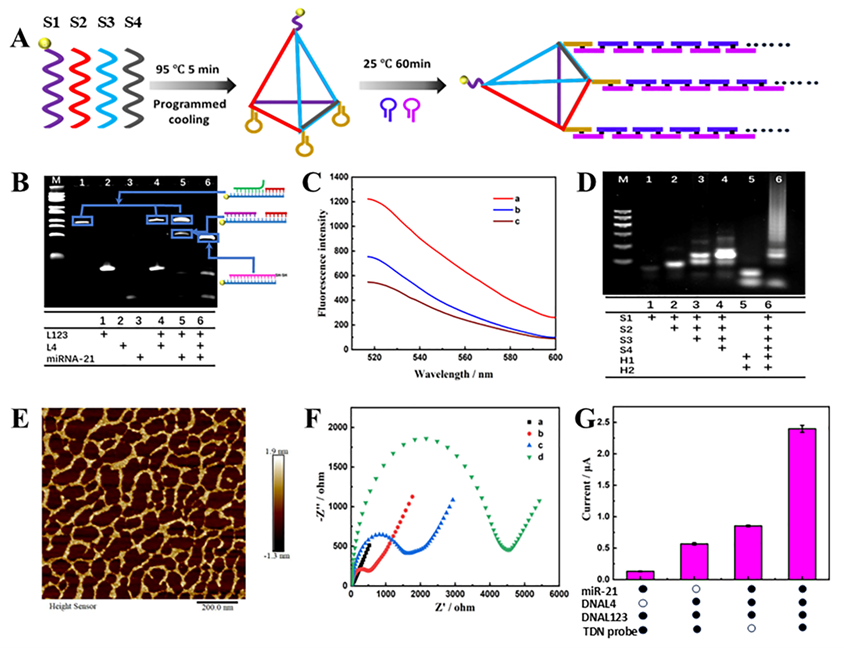
图2. 基于三重信号放大的无酶电化学生物传感检测外泌体miRNA的可行性分析参考文献:Enzyme-Free and Triple Sensitivity Amplification for Electrochemical Detection of Exosomal microRNA. Biosens Bioelectron 2025, 97(9):5244-5250.
外泌体资讯网 Anal Chem│南京大学项阳教授课题组研发了一种无酶的三重信号放大技术用于外泌体microRNA检测的新方法