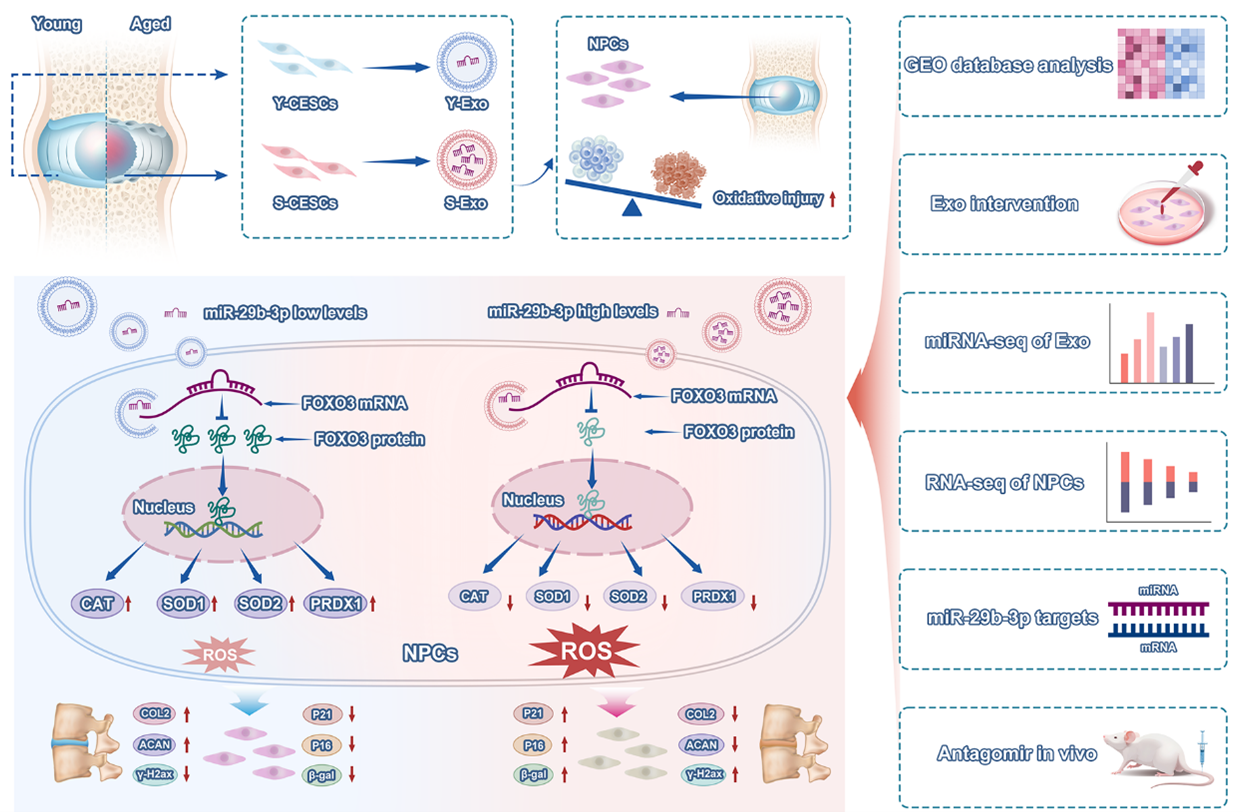
椎间盘退变的发病率随着年龄的增长而不断增加,给社会带来了沉重的经济负担。软骨终板组织是椎间盘中的关键支撑结构,其退变被认为是椎间盘退变的起始因素。软骨终板组织内含有软骨终板干细胞,软骨终板干细胞来源的外泌体(CESCs-Exos)可以介导软骨终板组织与髓核组织间的细胞间通讯,抑制髓核细胞的氧化应激损伤,从而缓解椎间盘退变的进程。近年来研究表明,外泌体来源细胞的衰老会影响外泌体的生物学功能,进而引发异常的细胞间通讯,促进疾病进展。然而,衰老软骨终板干细胞来源外泌体(S-Exos)和年轻软骨终板干细胞来源外泌体(Y-Exos)对髓核细胞氧化应激及椎间盘退变的作用机制仍有待阐明。
近日,陆军军医大学第二附属医院(新桥医院)李长青/刘铭汉/张超团队在Free RadicalBiology and Medicine杂志发表了题为“Senescent Cartilage Endplate Stem Cells-derived Exosomes Induce Oxidative Stress Injury in Nucleus Pulposus Cells and Aggravate Intervertebral Disc Degeneration by Regulating FOXO3” 的研究成果,探讨了S-Exos通过miR-29b-3p/FOXO3通路诱导髓核细胞氧化应激并加重椎间盘退变的作用机制。陆军军医大学第二附属医院骨科李长青教授、刘铭汉教授和张超教授为文章的共同通讯作者,陆军军医大学第二附属医院骨科卞志群硕士、翟羽医师为文章的共同第一作者。
该团队首先分析了71例人体退变椎间盘组织的转录组测序结果,揭示了氧化应激与椎间盘退变的正相关关系。在过氧化氢诱导的体外氧化应激模型和针刺诱导大鼠椎间盘退变模型中,团队发现与Y-Exos相比,S-Exos促进了髓核细胞的氧化应激损伤及椎间盘退变。为筛选S-Exos中发挥负面作用的关键成分,该团队采用miRNA测序技术,并结合功能验证实验,发现S-Exos中miR-29b-3p水平显著上调。体外转染miR-29b-3p mimics可模拟S-Exos对髓核细胞的氧化应激损伤效应。通过RNA测序和双荧光素酶报告基因实验联合分析,该团队阐明了miR-29b-3p通过靶向抑制FOXO3及其下游抗氧化酶(包括SOD1、SOD2、CAT和PRDX1)表达,进而诱导髓核细胞氧化应激损伤的分子机制。该研究团队设计合成antagomir-29b-3p以靶向抑制miR-29b-3p的生物学功能,动物实验显示椎间盘内注射该分子可显著降低髓核细胞氧化应激水平,从而延缓椎间盘退变进程。
该团队通过miRNA和RNA多组学分析,不仅阐明了S-Exos在破坏髓核内稳态和加重椎间盘退变中的作用及机制,还为CESCs-Exos供体细胞状态的精细选择提供了实证基础。通过设计合成小分子化合物antagomir-29b-3p靶向抑制miR-29b-3p,为椎间盘退变的临床干预提供了新的靶点和策略。
参考文献:
Senescent Cartilage Endplate Stem Cells-derived Exosomes Induce Oxidative Stress Injury in Nucleus Pulposus Cells and Aggravate Intervertebral Disc Degeneration by Regulating FOXO3. Free Radic Biol Med. 2025 Mar 19. doi: 10.1016/j.freeradbiomed.2025.03.027.
外泌体资讯网 FRBM|陆军军医大学第二附属医院李长青/刘铭汉/张超:揭示衰老软骨终板干细胞外泌体介导异常细胞间通讯在椎间盘退变中的作用机制





