肿瘤复发转移、耐药及免疫逃逸是肿瘤进展中的关键事件,具有显著的时空异质性和可塑性特征。肿瘤细胞与肿瘤微环境中其他细胞间的信息交流在这些进程中发挥着核心作用。细胞外囊泡(Extracellular Vesicles, EVs)作为携带生物活性分子的异质性分泌信使,介导了这种细胞间通讯,从而动态调控肿瘤演化进程。解析EVs的形成机制与调控通路,鉴定EVs介导的肿瘤转移、耐药及免疫应答中的关键网络与靶点,将为深入理解肿瘤进展规律提供新视角,并为肿瘤诊断与治疗提供创新性策略。
中山大学肿瘤防治中心康铁邦/高瑛团队在Science China-life Sciences杂志上发表题为“Extracellular Vesicles in Cancer Progression: Mechanisms and Significance”的综述论文,主要介绍了EVs的分类、新的EVs类型,以及EVs在肿瘤中的作用和机制。 第一作者高瑛,通讯作者康铁邦。
EVs是由细胞在生理或病理状态下分泌的脂质双层结构。根据生物发生机制和尺寸,经典的EVs亚型通常分为三类:外泌体(Exosomes)、微囊泡(Microvesicles, MVs)、凋亡小体(Apoptotic bodies)。近年研究发现多种新型EVs亚型,比如迁移体(Migrasomes)、收缩体(Retractosomes)、Rafeesome-R-EVs、线粒体囊(Mitopheres),这些发现拓展了对EVs异质性的认知,表1对比了各EVs亚型的粒径、起源、标志物及内容物特征(表1)。
| Types of EVs | Diameter | Origin | Markers | Content | Ref. |
| Exosome | 30-150 nm | MVB (endosomal pathway) | CD9, CD63, CD81 | Nucleic acids, lipids, proteins | (Dixson et al., 2023; Jeppesen et al., 2023) |
| Microvesicle | 100-1000 nm | Plasma membrane | Annexin A1 | Lipids, proteins, RNA | (Dixson et al., 2023; Jeppesen et al., 2023) |
| Apoptotic body | 100-5000 nm | Apoptosis cell | Annexin V | Histones, DNA, and proteins of nuclear, ER, and mitochondrial origin | (Dixson et al., 2023; Jeppesen et al., 2023) |
| Migrasome | 500-3000 nm | Bifurcation of Retraction fibers, tetraspanin-enriched macrodomains | TSPAN4, TSPAN7 | EVs, impaired mitochondria, mRNA, miRNA, protein, and so on | (Jeppesen et al., 2023; Tan et al., 2023) |
| Retractosome | 50-250 nm | Broken-off retraction fibers | PIGK, EOGT | Protein and other components | (Tan et al., 2023; Wang et al., 2022) |
| R-EV | 100-500 nm | Rafeesome (non-canonical autophagosome) | TMEM33, RTN4 | ER proteins, cytosolic protein, DNA and other components are still being explored | (Gao et al., 2022) |
| Mitopher | 490-1100 nm | Spermatid outward budding off | Mitochondrion | Only a single heathy mitochondrion | (Liu et al., 2023) |
表1. 比较各EVs类型的特征和差异
2022年康铁邦和高瑛团队发现并报道RAB22A可以诱导形成一种新的类似于多囊泡体的亚细胞结构, 被称为Rafeesome, 它是由RAB22A调控形成的非经典自噬体, 与RAB22A阳性的早期内体融合而成(Gao et al., 2022)。RAB22A可以诱导RAB7失活, 从而抑制Rafeesome与溶酶体的融合, 促进自噬体内层囊泡分泌到细胞外, 被称为R-EV(RAB22A-induced extracellular vesicles)。这类新型EV亚群R-EVs直径约100-500nm,尺寸介于外泌体和微囊泡之间(图1)。由于这种非经典自噬体起源于内质网,R-EVs可分泌内质网相关蛋白及与自噬受体结合的胞质蛋白。研究发现,激活的干扰素基因刺激因子(STING)能进入非经典自噬体,并作为Rafeesome-R-EVs的货物被分泌至肿瘤微环境,从而发挥抗肿瘤免疫效应。
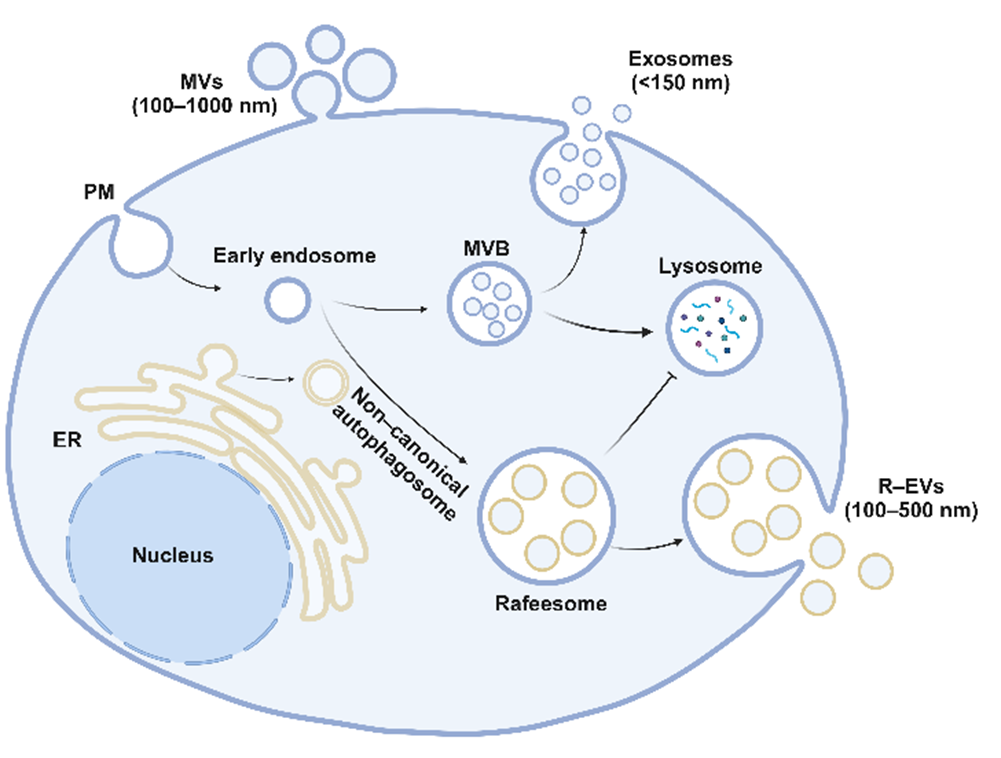
图1. EVs亚型:外泌体、微囊泡和Rafeesome-R-EV
康教授团队还发现了两种EGFR的胞外分泌途径—外泌体和微囊泡, 并证实EGFR突变体能够促进这一过程,从而实现肿瘤细胞间的EGFR信号传递(图2)。 一种是由RAB31调控的、不依赖于ESCRT的新型外泌体通路, 即: RAB31-FLOTs依赖于脂筏微域的外泌体通路,该通路介导表皮生长因子受体(EGFR)以外泌体形式分泌到细胞外(Wei et al., 2021)。另一种是RAB22A通过增强EGFR循环、抑制EGFR降解, 促进包含EGFR的微囊泡释放(Lin et al., 2024)。
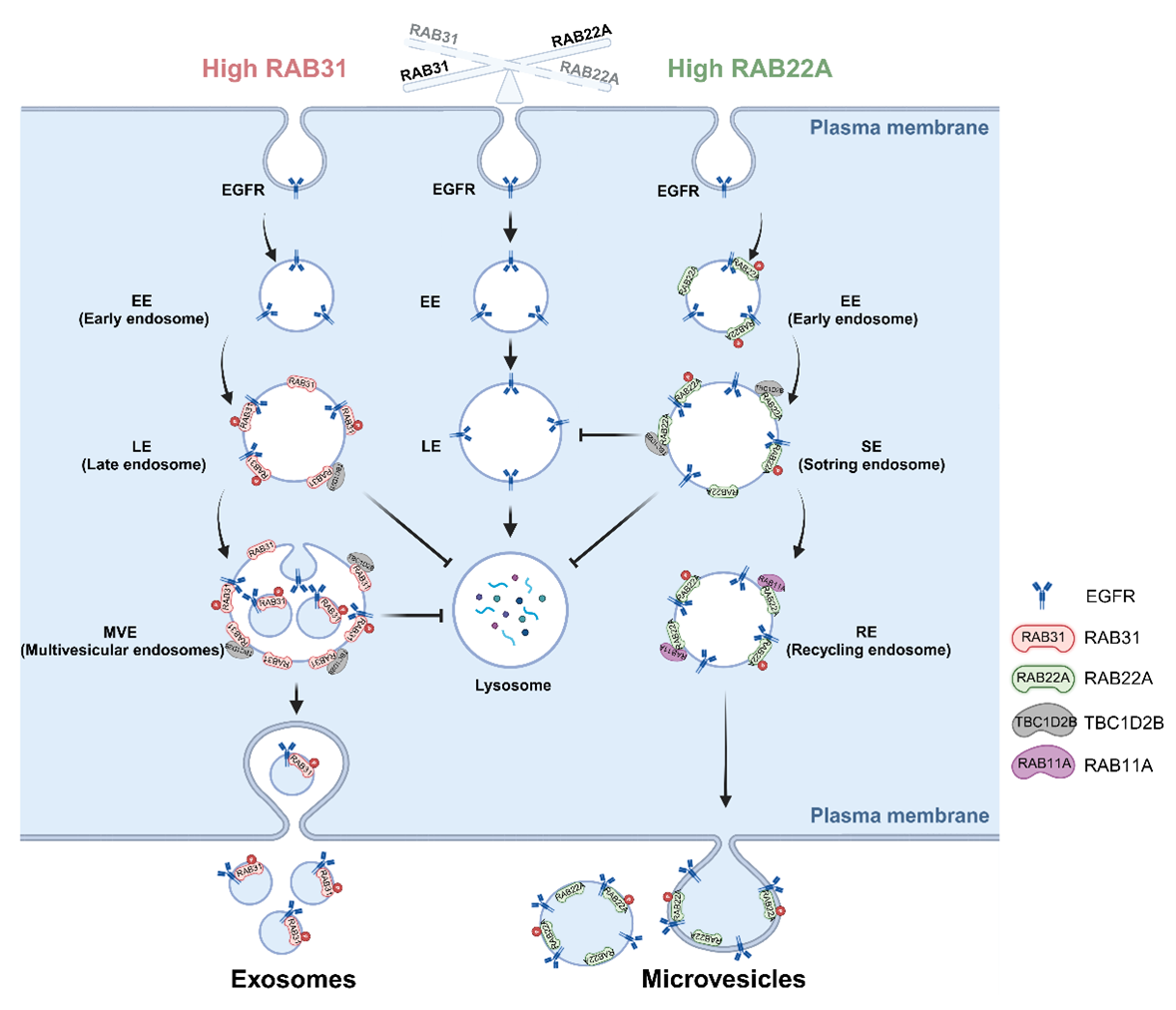
图2. RAB31和RAB22A分别以外泌体和微囊泡形式分泌EGFR
随着不同EVs亚群的不断发现,目前的一个关键挑战是缺乏高效、精准的分离纯化方法。现有技术(如基于粒径的富集方法)较为粗放,难以满足亚群精准分析需求。我们建议采用基于特异性标志物的富集方法,以分离不同EV亚群。此外,如何从血液、泪液、尿液等微量体液中高效提取各类EVs,仍是重点研究方向。EV分离与表征技术的进步,结合对其形成机制和调控通路的深入解析,将深化我们对肿瘤演进的认识,并为肿瘤诊断与治疗提供新策略。
参考文献:
Extracellular vesicles in cancer progression: mechanisms and significance, Sci China Life Sci.2025 Mar 25. doi: 10.1007/s11427-024-2852-9.





