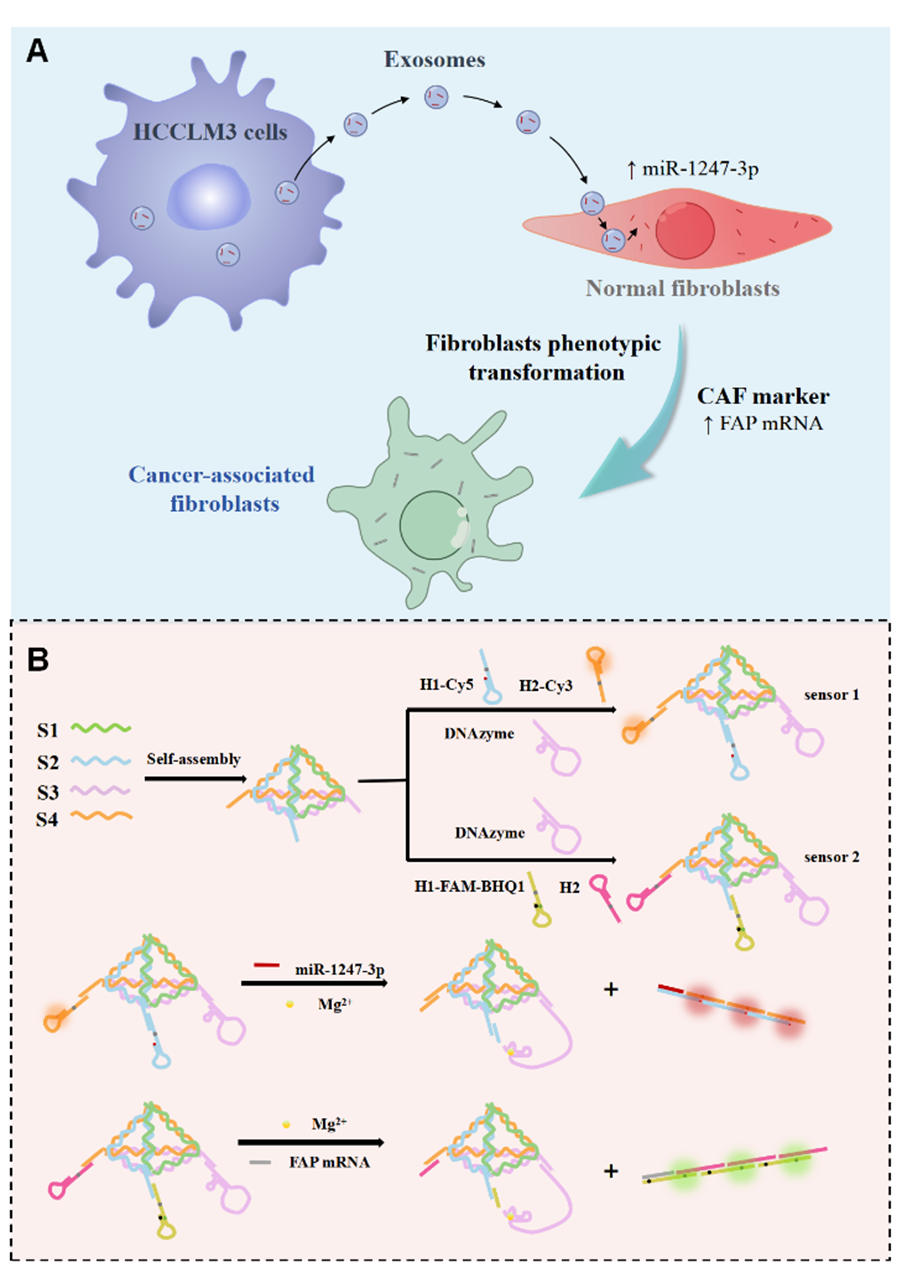
肿瘤侵袭和转移是肿瘤发生发展过程中最危险的阶段,而肿瘤微环境(TME)作为受细胞间通讯调节的动态系统,在癌症转移中扮演着关键角色。肿瘤相关成纤维细胞(CAFs)是TME中最丰富的细胞类型之一,通过分泌生长因子、细胞因子和细胞外基质,在促进肿瘤发生、增殖、血管生成、侵袭和转移中发挥重要作用。因此,研究正常成纤维细胞向CAFs的转化在推动癌症转移中具有重要意义。研究发现,肿瘤细胞来源的外泌体miRNA在细胞间通讯和TME通讯中发挥重要作用。例如,外泌体miRNA通过调控细胞增殖、迁移、血管生成和上皮-间充质转化(EMT),显著促进肿瘤侵袭和转移。此外,外泌体miRNA还可诱导正常成纤维细胞向CAFs的转化,进一步增强EMT并赋予肿瘤细胞扩散能力。例如,外泌体miR-1247-3p已被证明通过调控CAFs的活化,促进肝癌的肺转移。然而,尽管传统研究方法(如qRT-PCR、Western blot和免疫荧光)能够验证目标基因和CAFs的产生,但目前仍缺乏对成纤维细胞向CAFs转化过程的动态可视化研究。因此,通过分析肿瘤来源的外泌体,探索成纤维细胞表型转化的可视化机制,对于深入理解肿瘤侵袭和转移的分子机制、开发新型治疗策略具有重要意义。
近日,湖南师范大学张友玉教授课题组在Analytical Chemistry杂志上发表题为“Visualization of Cancer Cell-Derived Exosome-Induced Fibroblast Phenotypic Transformation”的论文,以外泌体miRNA为靶点,追踪肿瘤细胞来源的外泌体对正常成纤维细胞的侵袭情况,并利用CAFs生物标志物——成纤维细胞激活蛋白信使核糖核酸(FAP mRNA)进一步追踪外泌体对受体细胞的影响。基于杂交链式反应信号放大策略和荧光共振能量转移机制,开发了两种DNA四面体传感器。这两种传感器能够对肿瘤来源外泌体侵袭后的活细胞进行成像,有助于可视化监测成纤维细胞表型转化,为揭示癌症转移发展提供了新视角。第一作者尹书杭,通讯作者张友玉教授和朱效华副教授。
该研究开发了两种DNA四面体框架传感器,用于监测肿瘤外泌体诱导的成纤维细胞表型转化。如图1所示,传感器1通过靶向外泌体中的miR-1247-3p,在Mg²⁺ 存在下触发DNAzyme切割和HCR反应,产生Cy3到Cy5的FRET信号,实现miR-1247-3p的特异性检测。传感器2则通过靶向CAF标志物FAP mRNA,在Mg²⁺ 存在下切割发夹链,使FAM荧光团与BHQ1淬灭剂分离,恢复FAM荧光信号。结合这两种传感器对肿瘤外泌体侵袭活细胞后的miRNA和癌症相关成纤维细胞的生物标志物进行成像,最终实现了对成纤维细胞表型转化的可视化监测,为癌症转移过程提供了新的监测工具。
图1:(A)肿瘤细胞来源的外泌体诱导成纤维细胞表型转化的机制示意图。(B)两种 DNA四面体框架传感器的构建及工作原理示意图。
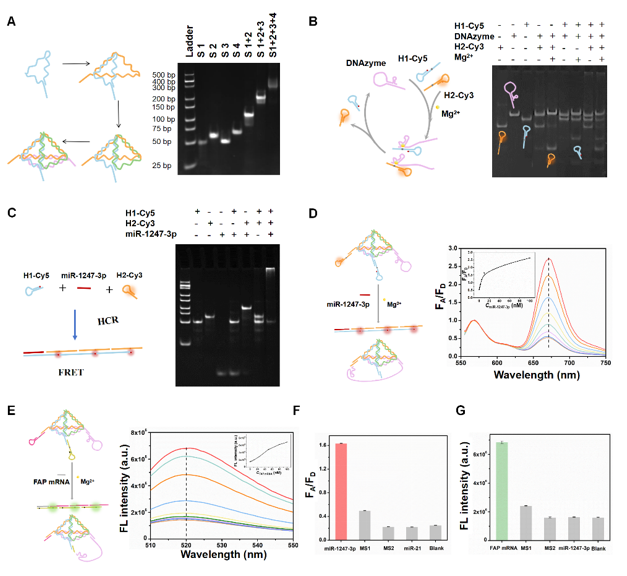
该研究首先进行了DNA四面体传感器的构建与表征,如图2所示,通过非变性聚丙烯酰胺凝胶电泳(Native-PAGE)实验验证了DNA四面体框架的成功组装,并显示DNAzyme仅在Mg²⁺存在时切割发夹链。进一步通过Native-PAGE分析杂交链反应(HCR)产物,发现目标miR-1247-3p触发HCR,产生明亮的梯状条带特征,证明HCR成功。荧光检测结果显示,传感器1对miR-1247-3p的检测线性范围为50 pM至10 nM(R²=0.994),检测限4.94 pM;传感器2对 FAP mRNA 的线性范围0-100 nM(R²=0.988),检测限6.61 pM。特异性实验证明两种传感器仅在同时存在目标Mg²⁺ 和miR-1247-3p或FAP mRNA时产生显著荧光信号,表明传感器具有良好的特异性。研究结果表明该传感器系统具有高灵敏度、特异性及生物相容性。
图2:DNA四面体传感器的构建与表征
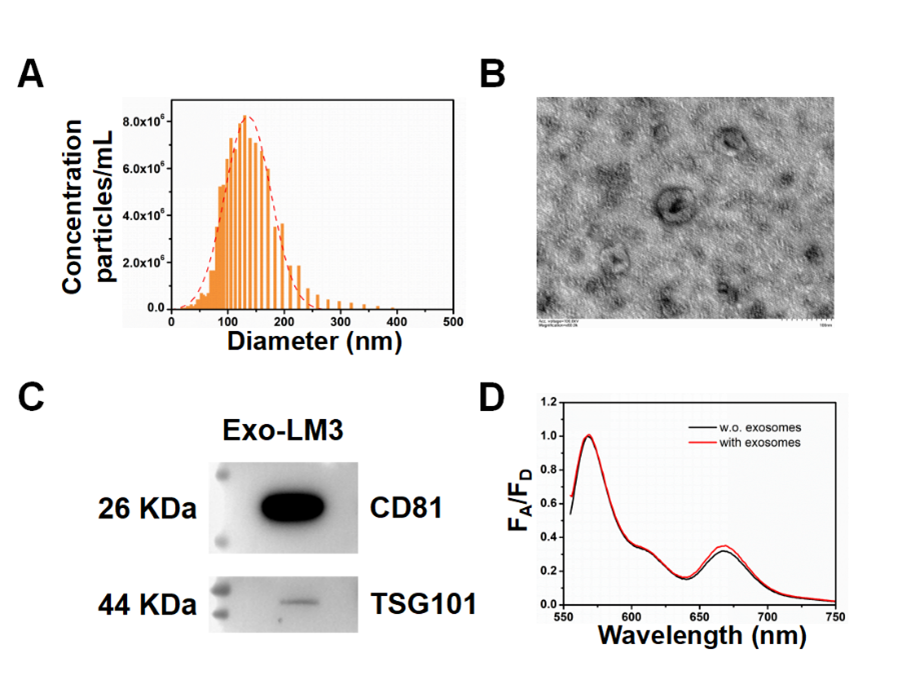
该研究根据ISEV 2018指南,通过超速离心分离出HCCLM3细胞分泌的外泌体,并对其形态、特征蛋白和粒径分布进行了表征。如图3所示,透射电子显微镜显示外泌体呈典型杯状形态,粒径约100 nm;Western blot验证了外泌体表面TSG101和CD81蛋白的表达。进一步实验表明,传感器1与肿瘤细胞来源外泌体孵育后FRET信号显著增强,验证了其对miR-1247-3p的有效检测能力。
图3:HCCLM3细胞分泌的外泌体的表征
进一步研究发现传感器1与不同浓度外泌体处理的MRC-5细胞共孵育,如图4所示,FRET信号随外泌体浓度增加而增强,证明传感器1能够检测到HCCLM3细胞分泌的外泌体中的miR-1247-3p,并证实外泌体确实将miR-1247-3p传递到了受体细胞MRC-5中。为了研究HCCLM3细胞来源的外泌体是否能调控MRC-5细胞的表型转化,研究者利用传感器2检测了与不同浓度外泌体共孵育24小时后的MRC-5细胞中与癌症相关的成纤维细胞标志物FAP mRNA。结果表明,随着外泌体浓度的增加,荧光强度显著增强,说明HCCLM3外泌体促进了MRC-5细胞向癌症相关成纤维细胞的表型转化。为了研究外泌体中miR-1247-3p在成纤维细胞表型转化中的作用,将MRC-5细胞与外泌体共孵育后,分别转染miR-1247-3p模拟物和抑制剂,24小时后与传感器2孵育。结果显示,与未转染miRNA的对照组相比,miR-1247-3p抑制剂处理组荧光减弱,而模拟物处理组荧光增强,表明肿瘤来源外泌体中的miR-1247-3p可促进成纤维细胞的表型转化。流式细胞术验证了共聚焦成像结果。
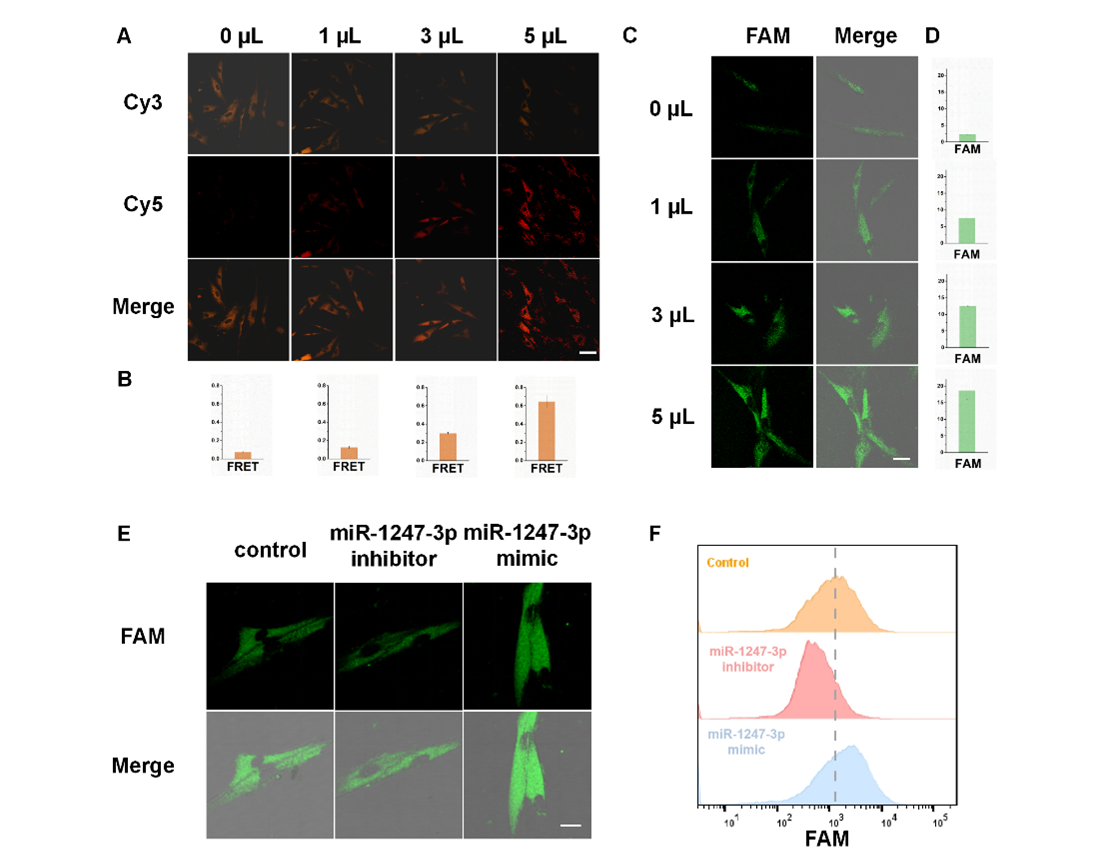
图4:DNA四面体传感器的成像性能
由于传感器1被设计为能够与miR-1247-3p特异性杂交,推测其可能具有与miR-1247-3p抑制剂相似的功能,从而抑制成纤维细胞的表型转化。将不同浓度的传感器1与外泌体处理的MRC-5细胞共孵育24小时后,再与传感器2孵育,利用共聚焦成像技术和设计的两种传感器,成功实现了对肿瘤来源的外泌体诱导成纤维细胞表型转化过程的可视化监测。如图5所示,随着传感器1浓度的增加,Cy3通道的荧光信号逐渐减弱,而Cy5通道的荧光信号显著增强,表明FRET信号提高,同时FAM通道的荧光信号减弱。这些结果通过流式细胞术实验进一步验证,显示与共聚焦成像结果高度一致。结果表明,传感器1不仅能追踪细胞内的miR-1247-3p,还能抑制其功能,降低细胞内FAP mRNA表达,填补了可视化监测该过程的空白。
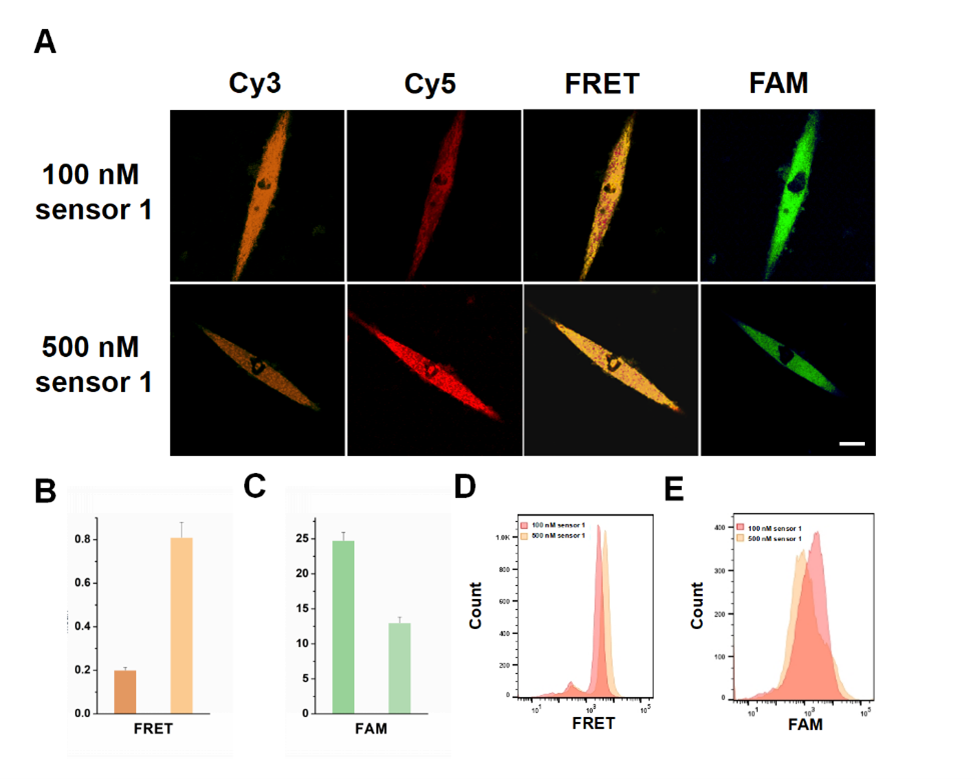
图5:肿瘤细胞来源的外泌体诱导成纤维细胞表型转化的可视化
综上所述,该研究设计并构建了两种DNA四面体传感器,分别用于特异性追踪肿瘤来源的外泌体miRNA和癌症相关成纤维细胞的生物标志物。这两种传感器在体外检测中表现出优异的选择性和灵敏度。通过将两种传感器结合应用于活细胞成像,实现了对肿瘤来源的外泌体侵袭后成纤维细胞表型转化过程的可视化监测。此外,研究发现该传感器不仅能够高效检测靶标,还能够通过抑制miRNA功能阻断成纤维细胞的表型转化过程。这一发现为癌症转移过程的实时监测提供了新型工具,同时展现了其在抑制癌症转移发生和发展中的潜在应用价值,为肿瘤诊断和治疗策略的开发提供了新的研究方向和技术支持。
参考文献:
Visualization of Cancer Cell-Derived Exosome-Induced Fibroblast Phenotypic Transformation. Anal Chem 2025. DOI: 10.1021/acs.analchem.4c06175.