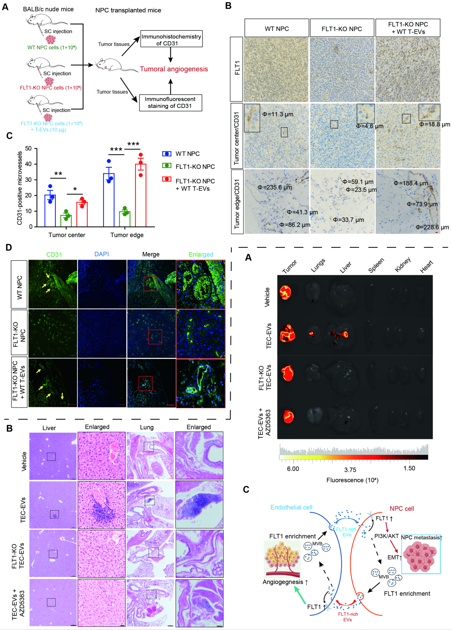
鼻咽癌(Nasopharyngeal carcinoma, NPC)作为鼻咽部上皮组织高发的头颈部恶性肿瘤,远端转移和局部复发是导致其治疗失败的主要原因。然而,虽然肿瘤微血管的形成是肿瘤远端转移的关键基础,但缺乏新的视角来解析肿瘤微血管的形成与肿瘤转移的动态协同机制。近年来,大量研究表明,细胞外囊泡(Extracellular vesicles, EVs)可通过传递不同的蛋白、核酸、脂质等分子进行细胞间信息交流,介导肿瘤转移特性的转变,决定肿瘤转移的靶向性与转移进程。
近日,中山大学张擎团队在Oncogene杂志上发表了题为“FLT1-enriched extracellular vesicles induce a positive feedback loop between nasopharyngeal carcinoma cells and endothelial cells to promote angiogenesis and tumour metastasis”的研究论文,揭示了富含FLT1的EVs通过介导血管内皮细胞与鼻咽癌细胞间正向反馈,进而促进肿瘤微血管形成和鼻咽癌转移的协同机制。该论文第一作者为李飞博士后,通讯作者为张擎副教授。该研究得到了国家自然科学基金面上项目、青年项目、中国博士后科学基金以及广东省基础与应用基础研究基金等项目资助。
为了探索血管内皮细胞与NPC细胞之间是否存在EVs介导的信息交流,研究人员设计了以0.4µm孔径膜分隔的内皮细胞与NPC细胞的非接触共培养体系,分别进行mCherry-CD63转染特定内皮细胞或NPC细胞,发现在非接触情况下mCherry-CD63标记内皮细胞后能在NPC细胞中观察到mCherry-CD63囊泡颗粒,反过来也能在mCherry-CD63标记NPC细胞后在内皮细胞中观察到mCherry-CD63囊泡颗粒,提示内皮细胞和NPC细胞间存在EVs介导的信息传递。随后研究人分离提取了内皮细胞和NPC细胞EVs,通过荧光标记EVs后进一步证明内皮细胞与NPC细胞能够内吞彼此EVs。而为了更加准确研究肿瘤微环境中肿瘤内皮细胞(TECs)与NPC细胞间的相互作用关系,研究人员通过免疫磁珠法分离了TECs,进而分离提取了TECs分泌的EVs,进一步证明了TECs与NPC细胞间存在EVs的传递。
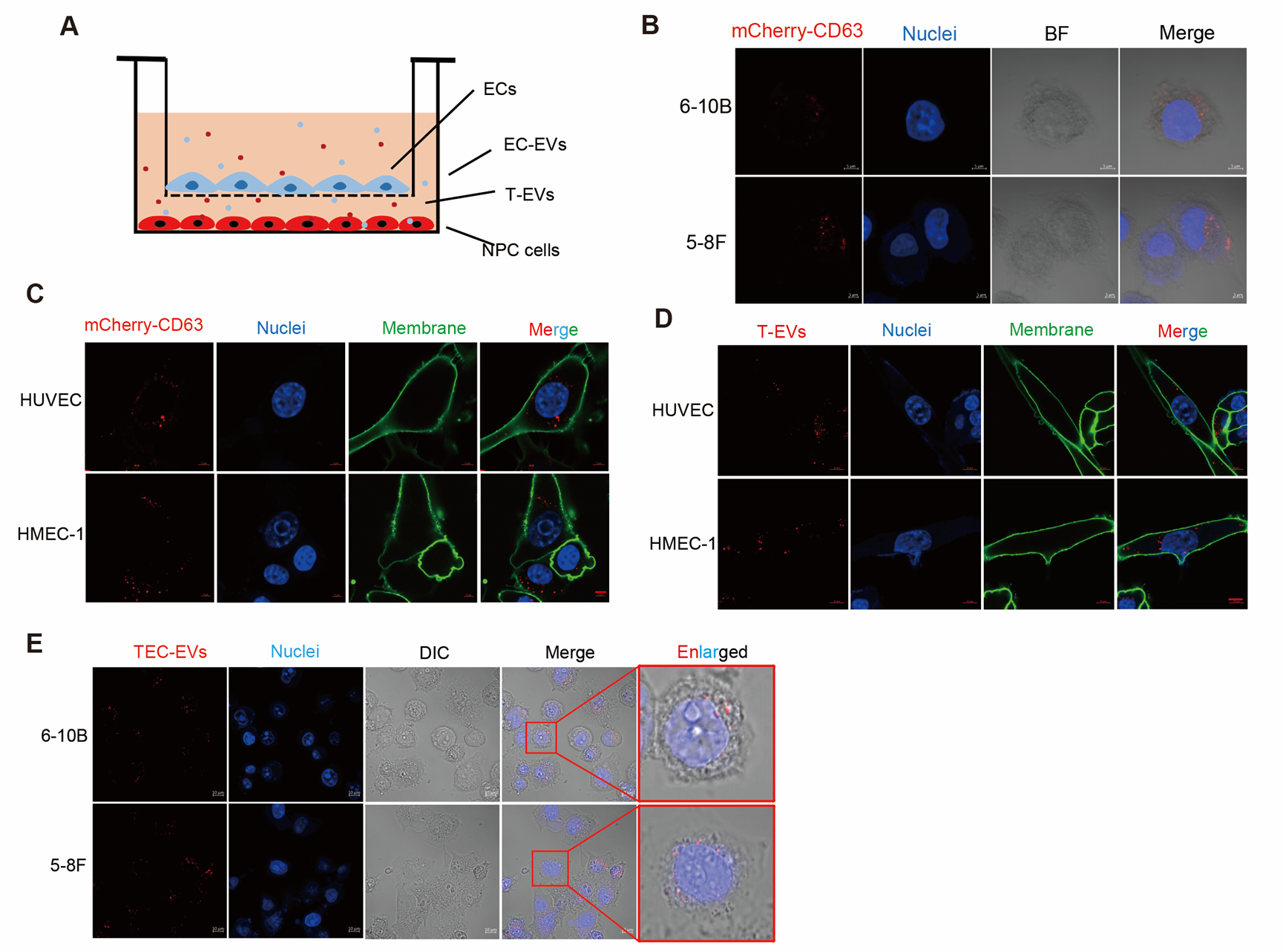
图1. EVs介导内皮细胞与NPC细胞间信息传递
随后,研究人员发现相较于正常内皮细胞EVs,TECs来源EVs能够明显促进NPC细胞迁移、侵袭、克隆形成以及EMT进程;而NPC细胞EVs在进入内皮细胞后则明显促进其血管生成能力,表明EVs在肿瘤组织中TECs与NPC细胞间传递可有效促进血管生成和肿瘤转移。结合临床数据库与临床样本分析,研究人员发现EVs在介导TECs与NPC信息传递过程中,能够有效富集FLT1并直接将FLT1分子传递至靶细胞中,进而上调彼此细胞质和细胞膜上FLT1表达。
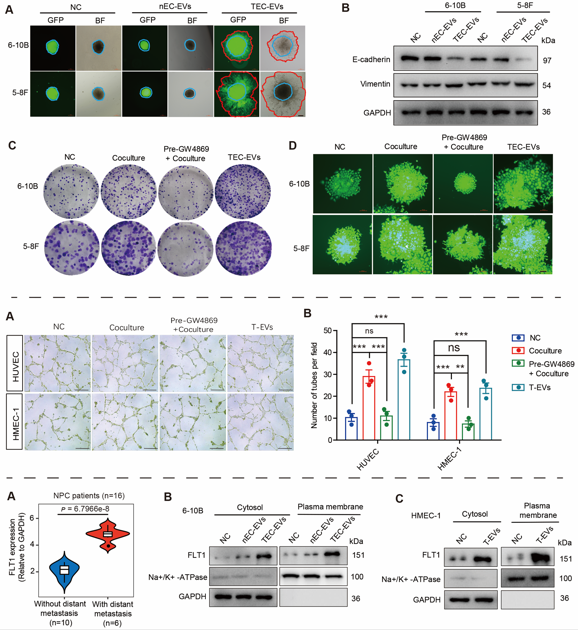
图2. TECs与NPC细胞间EVs传递促进NPC转移与血管生成并上调彼此FLT1
最后,通过小鼠移植瘤模型,研究人员证实了FLT1缺失的肿瘤组织中肿瘤微血管生成明显被抑制,而EVs传递FLT1则能有效恢复肿瘤微血管的形成;同时,FLT1富集的肿瘤内皮细胞EVs能够通过激活PI3K/AKT途径促进NPC的体内远端转移。
图3. 富含FLT1 EVs促进肿瘤微血管形成和NPC转移
总的来说,该研究揭示了EVs作为信息传递载体在肿瘤内皮细胞与NPC细胞间通过形成正向反馈,富集并上调彼此FLT1表达,进而协同促进肿瘤微血管形成和NPC转移的分子机制,为以富含FLT1 EVs为靶标的NPC转移监测和诊断技术的开发提供了新的理论依据。
参考文献:
FLT1-enriched extracellular vesicles induce a positive feedback loop between nasopharyngeal carcinoma cells and endothelial cells to promote angiogenesis and tumour metastasis. Oncogene (2025). https://doi.org/10.1038/s41388-025-03389-x.
外泌体资讯网 Oncogene|中山大学生命科学学院张擎团队:FLT1富集的EVs介导血管内皮细胞与鼻咽癌细胞间正向反馈促进血管生成与肿瘤转移