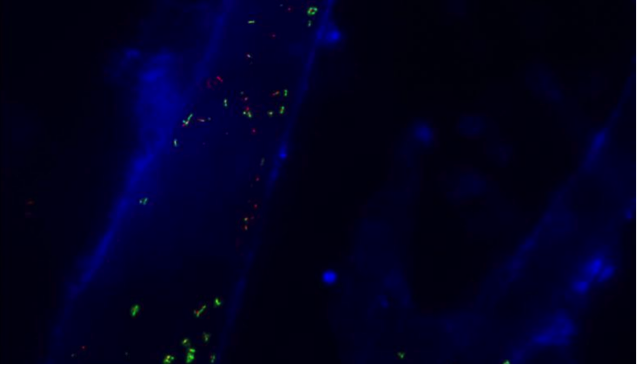
外泌体是由细胞分泌的小膜泡,富含大量的蛋白质。考虑到外泌体在不同生理活动中的显著作用以及在诊断、药物释放方面潜在的价值,研究人员在外泌体的体外追踪和内含物分析方面做了很大的努力。近日,各种超分辨率显微镜的出现为外泌体的研究提供了强大的工具。近日,东南大学先进光子学中心主任崔一平教授团队在ACS applied materials & interfaces杂志(IF=7.145)发表文章,展示了超分辨率成像技术(PALM / STORM)的单分子定位在癌症外泌体的成像和示踪上应用。在实验中,首先从肿瘤细胞的培养基中提取癌细胞来源的外泌体。然后将外泌体膜受体标记上光控探针,通过光敏定位显微镜(PALM)或随机光学重构显微镜(STORM)即可对这些膜受体进行超分辨率成像。使用人类乳腺癌细胞来源的外泌体,发现对外泌体的2种膜受体同时标记可利用PALM/STORM同时成像。成功地对外泌体进行标记和成像使得研究人员能够观察癌症外泌体和正常细胞之间的相互作用。同时,PALM/STORM成像显示癌症外泌体与受体细胞的溶酶体是共定位的。由于外泌体在细胞间通信过程中起到了至关重要的作用,研究人员预计PALM/STORM对外泌体的成像和追踪在外泌体介导的肿瘤转移的机制研究过程中具有很大的潜力。
超分辨率荧光显微技术是2014年诺贝尔化学奖
2014年诺贝尔化学奖授予Eric Betzig,Stefan W. Hell和William E. Moerner3位科学家,以表彰他们在超分辨率荧光显微成像技术方面的重大贡献。
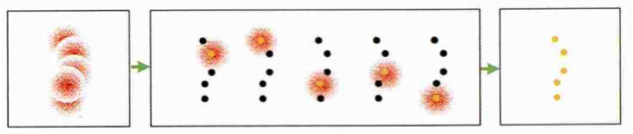
基于随机单分子定位的超分辨技术的核心是,如果图像上的点不是同时亮起来,也就是不会有两个靠得很近的点同时亮,就可以通过定位的方式实现超分辨。虽然一次定位只能得到少数几个分子,但是通过数千张图片对数十万个单分子的定位,就可以获得一张高分辨率的图像。
基于随机单分子定位的PALM/STORM超分辨原理图
这一超分辨技术发明于2006年,由本次诺贝尔奖得主Eric Betzig(光活化定位显微术PALM技术)、哈佛大学教授庄小威(随机光学重构显微术STORM技术)、以及Samuel Hess(荧光活化定位显微术fPALM技术)3个研究组分别同时独立发明,分别发表于Science,Nature Methods 和 Biophysical Journal。3种技术的原理非常像,都是基于荧光分子的光转化能力和单分子定位,通过用光控制每次仅有少量随机离散的单个荧光分子发光,并准确定位单个荧光分子点扩展函数的中心,通过多张图片叠加形成一幅超高分辨率图像。
William E. Moerner是单分子荧光技术的先驱人物。他在1989年任职于美国IBM研究中心时在世界上首次实现了单个分子的光吸收的测量,并在1997年与发展绿色荧光蛋白技术而获得2008年诺贝尔化学奖的钱永健合作,发现了绿色荧光蛋白的光转化效应。而Eric Betzig是荧光显微技术领域的领军人物。他在1994年提出了基于单分子信号实现超高分辨率成像的思想,并于2006年在实验中得以实现。庄小威作为 STORM 超分辨技术的发明人,一直领导并推进着超高分辨率显微技术的发展和应用,是近8年来这个领域最活跃的研究团队。
参考文献:
Chen, C., et al. (2016). "Imaging and Intracellular Tracking of Cancer Derived Exosomes Using Single Molecule Localization Based Super Resolution Microscope." ACS Appl Mater Interfaces. IF=7.145
版权归外泌体之家所有,欢迎转载,但请注明出处和原文链接!
原文下载和讨论请点击:http://www.exosome.com.cn/thread-1126-1-1.html?_dsign=2655e0ad