尽管人们在疾病诊断技术上的投入巨大,但是许多病症的诊断方法仍然既繁琐又昂贵,并且往往难以在症状不明显的早期及时发现疾病。胰腺癌就是一个典型例子:早期胰腺癌并无明显症状,但病情发展却十分迅速。事实上,根据美国癌症协会(American Cancer Society)统计,高达80%的胰腺癌患者在确诊后的一年内死去。
近日,美国亚利桑那州立大学“Virginia G. Piper个体化诊断生物设计”研究中心的胡晔教授和他的同事们设计了一种精巧的方法,来解决胰腺癌早期诊断的问题。这种诊断方法的基本原理是对血液中的肿瘤特异细胞外泌体(extracellular vesicles,EVs)的高灵敏检测。
在Nature Biomedical Engineering杂志最新在线发表的这项研究中,胡教授和他的同事报道了该方法:它能够直接检测源自肿瘤细胞的EVs,这些囊泡上携带了特定的膜蛋白作为胰腺癌的标志物。准确测定这种名为EphA2的膜蛋白,使得这些肿瘤EVs能够用于诊断早期胰腺癌。
胡晔教授介绍:“胰腺癌是一种极其需求早期血检标志物的癌症”。目前,胰腺癌的唯一有效治疗手段仍然是手术切除患病组织。但是,由于胰腺癌快速的进展,在确诊过程期间就容易发生扩散,使得手术治疗往往变得不再可行。“也有一些其他的胰腺癌检测技术,但是由于这种癌症的特征,使得这些技术的效果往往比较有限。在毫无症状时通常很难捕捉到疾病的早期信号。它不像乳腺癌,患者能够感觉到疼痛,从而容易检查到不正常的增生”。
这项工作通过两个不同纳米粒子之间的相互作用检测肿瘤分泌的EVs,进而可利用这种方法将胰腺癌患者的血液样品与胰腺炎患者(与胰腺癌有相似的症状)及健康人的血样区分开来。更重要的是,不同疾病都有其特异性的EVs,因而这种技术能够进一步用于更广泛疾病类型的快速灵敏检测。
聚焦EVs
真核细胞(包括人类细胞)和原核细胞(比如细菌细胞,它们缺少细胞核及一些其他膜成分)都会分泌EVs。EVs可以看作是其来源母细胞的缩小版,虽然囊泡中并不存在细胞中复杂的细胞器。
细胞通过不同的路径分泌不同类型的EVs。本研究关注的是一种称为“外泌体(exosomes)”的囊泡,它的尺寸大约在50-150纳米的范围。外泌体来自于细胞内部一种名为“内涵体”的膜结构中,内涵体的膜结构会最终与细胞质膜相融合,同时将外泌体释放到胞外空间。
曾经人们认为EVs仅仅是细胞代谢活动的遗留物,但是现在研究者逐渐意识到EVs承担着关键性的远程运输职能。人们对这一问题的研究还处于起步阶段。EVs构成了细胞间极其精密复杂的通讯网络,并且在不同物种间高度保守,显示了它们在生命过程中的重要作用。其生物活性之一是在不同细胞间转运核酸、蛋白质、和脂质,进而在母体细胞和靶细胞引发生理或病理变化。在先天性免疫和获得性免疫响应中EVs也扮演了重要的角色。
EVs指示健康与疾病
研究显示,在许多疾病中,循环系统中的EVs数量会显著升高。在特定癌症的发生和发展中,EVs也扮演了重要的角色,包括胰腺癌。肿瘤EVs离开其母体细胞,迁移到其他正常组织,能够影响目标组织的周围环境,创造出一个适合肿瘤浸润和生长的微环境,这是EVs在肿瘤转移中的一个显著功能。就像新大陆的拓荒者,EVs能够为后续癌细胞的入侵开辟道路。
也有证据表明,肿瘤来源的外泌体能够通过排出抗肿瘤药物或“中和”抗体药物来增加肿瘤细胞的抗药性。
由于血液中肿瘤来源的EVs水平会随着肿瘤生长而增加、同时随着癌症的有效治愈而下降,因此EVs有可能作为快速评估癌症进展和治疗响应的一个非手术指标。
发现像EphA2这样的肿瘤EVs蛋白,以及更好的理解EVs在肿瘤发生和转移过程中的作用,将为癌症诊断和预后监控翻开新的篇章。由于胰腺癌化疗中发生药物耐受的几率较高,人们同样亟需有效的胰腺癌预后监控手段,从而能够及时修正个体化治疗方案、改善疗效。并且,更好的理解与癌症有关的EVs上的特异性活性因子,有可能发现新的癌症治疗靶点、促进个体化癌症治疗的发展。
临床诊断界的曙光
EVs能够从非常广泛的细胞类型和生物体液(如唾液、尿液、血液、乳汁、精液、羊水以及鼻腔和气管灌洗液)中分离出来,使得EVs成为一种极具潜力的疾病标志物来源。但是,主要问题在于,如何将疾病相关的EVs与体液中的其他普通EVs区分开来。现有的EVs分析手段往往需要复杂繁琐的EVs分离和纯化过程,难以在临床机构中推广。能够准确鉴别疾病相关EVs的有效标志物与方法更是无从谈起。
这里所发展的基于纳米粒子的技术,能够通过简单的样品处理,快速检测肿瘤相关的EVs,解决了上述提到的问题。
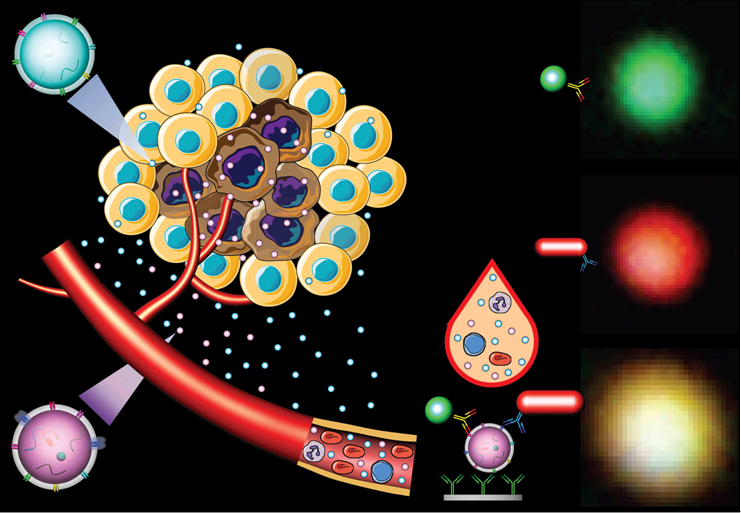
极微量的血液(最小可达1微升,小于一滴眼泪的体积)在经过稀释后滴加到一片传感芯片上,芯片表面修饰了一层EVs膜蛋白的抗体。EVs通过这个抗体被捕获到芯片表面,然后与两种抗体修饰的纳米粒子相互作用——绿色的纳米球识别第二个EVs表面膜蛋白,红色纳米棒识别胰腺癌标志蛋白EphA2。只有胰腺癌组织分泌的EVs能够同时结合两种纳米粒子。这两个纳米粒子由于结合在一个囊泡上,引起二者近距离的偶合作用,进而显著改变了它们折射光的颜色和强度,这种改变在暗场显微镜下能够清楚的观察到(如图所示)。
胡教授和他同事进行的一系列实验证明,这种方法能够将胰腺癌、甚至是早期胰腺癌患者的血样与胰腺炎和健康人的样品灵敏的区分开来。同时,这种方法还能够监测到不同治疗效果的患者血液中EphA2-EVs水平的不同,说明这项技术也有可能用来监测癌症治疗的预后情况。
虽然目前这项技术利用光学显微镜作为信号监测方法,但是研究者正在发展全自动的仪器平台,以使该技术能够变得更加方便和高通量,便于在临床机构推广。胡教授已经有意将这项新的技术转化为实际的临床应用,当然,估计仍需要2-3年的时间来等待FDA的批准。
EVs的广阔前景
不仅是胰腺癌,通过将纳米粒子上的抗体更换为其他疾病的特异性探针,这项技术就能够利用EVs检测更加广谱的疾病类型。
胡晔教授和同事已经在小规模的临床研究中证实了这种方法可用于检测肺结核样本。在这项研究中,病人的尿液样本中能够检测到丰富的结核菌分泌的EVs。这一激动人心的结果为非侵入性的结核病快速诊断开启了新的大门。临床上结核病的标准检测样本是病人的痰液,但是对于无法提供痰液样本的病人,往往需要进行一项或多项侵入式的检查。对于这些病人,一种非侵入式的新检查手段具有非常重要的意义。
目前,与各种疾病相关的EVs应用研究正在加速进行。一些研究者甚至在探索EVs作为药物载体或治疗制剂的可能。曾经被认为是细胞垃圾的EVs,其潜在的生物医学应用正变得越来越广阔。
参考文献:
Liang K., Liu, F., Fan, J., Sun, D., Bernard, D. W., Li, Y., Katz, M. H., Koay, E. J., Zhao, Z., Hu, Y. Nanoplasmonic Quantification of Tumor-derived Extracellular Vesicles in Plasma Microsamples for Diagnosis and Treatment Monitoring. Nature Biomedical Engineering. 2017, Accepted.
编译来源及链接:Seninels in bloods: a new diagnostic for pancreatic cancer. https://biodesign.asu.edu/news/sentinels-blood-new-diagnostic-pancreatic-cancer
本文系论文作者编译,转载请注明编译来源及链接!