细胞来源的膜融合囊泡的释放越来越多被认为是细胞间通讯的机制。细胞外囊泡(EVs)或外泌体可以由病毒感染的细胞产生,并被认为会参与感染细胞与未感染细胞之间的细胞间通讯。病毒,特别是会造成慢性感染的致癌病毒和其他病毒,已被证明可以调节EV的产生和内容物。病毒miRNA、蛋白质甚至整个病毒粒子可以融合进入EVs,这会影响病毒的免疫识别或对周边细胞进行调控。6月26日,来自美国北卡罗来纳大学教堂山分校的研究人员在NATURE REVIEWS MICROBIOLOGY杂志(IF 26.819)上发表综述,讨论了EV在病毒感染期间的作用,即促进或限制靶细胞中的病毒复制。研究人员还讨论了病毒修饰EV的分子机制、宿主被感染后的潜在后果以及可能的未来诊断应用。
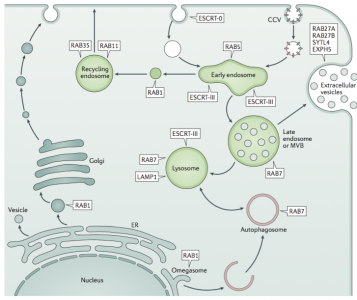
图1:病毒感染时的细胞的EV生物合成
细胞外囊泡(EVs)可以由健康的、恶性的以及被病毒感染的细胞分泌。EV可以直接从质膜释放,也可以通过多泡体(MVB)和质膜间的融合后释放。从MVB释放的EV称为外泌体。与EV类似,病毒从细胞的释放也是通过这几种途径的,包括质膜和MVB途径。例如,一些逆转录病毒,例如HIV-1,是在质膜的内膜上组装的,而其他逆转录病毒,例如Mason–Pfizer猴病毒(MPMV),是先在胞浆中装配然后再到细胞表面的。一些病毒是非包膜结构的,不需要有感染性的包膜,但是尽管如此,它们也可以融合入EV中以便释放。例如,甲型肝炎病毒(HAV)在最近研究发现在EVs中分泌,从而传染给未感染的细胞个体内。
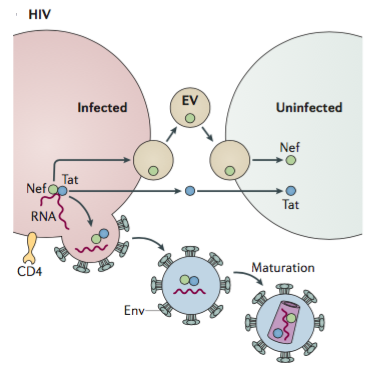
图2:EV与HIV病毒间的相互作用
在研究病毒感染时,研究这些囊泡对病毒发病机制的潜在贡献至关重要,因为来自病毒感染细胞的EV经常将病毒组分转移到未感染细胞中;例如Epstein-Barr病毒(EBV)中的latent membrane protein 1(LMP1)和病毒miRNA。这种病毒内容物的细胞间转移并不会发生在细胞间细胞融合、细胞突触或微管的接触,这意味着在没有病毒传播的情况下可以发生的宿主转移机制。EV具有细胞间运输的作用,例如从T细胞到突触间的传播。在这过程中,许多囊泡同时具有类似于EV和病毒的生物发生和融合机制的特征。值得注意的是,在这种条件下,囊泡倾向于停留在附近的微环境中,例如淋巴结,不会在全身体液循环中出现。
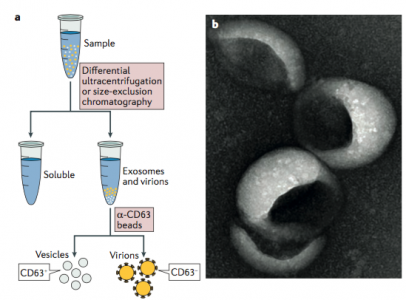
图3:EV和病毒粒子的分离方法
在本综述中,研究人员重点介绍了从病毒感染细胞释放的EVs的分子生物学特性。此外,研究人员还探讨了病毒修饰的EV是如何促进病毒感染的,是促进对免疫识别抗体的抵御或是抑制固有免疫。特别研究人员重点关注了HIV-1、HAV和HCV以及两种疱疹病毒EBV和Kaposi肉瘤相关疱疹病毒(KSHV)这几种人类病毒的感染。在慢性、持续性和潜伏感染的背景下,病毒对EV的内容物和功能的影响非常大。
参考文献:Raab-Traub N, Dittmer DP. Viral effects on the content and function of extracellular vesicles. Nat Rev Microbiol. 2017 Jun 26. doi:10.1038/nrmicro.2017.60.
原文下载:http://www.exosome.com.cn/thread-1633-1-1.html?_dsign=72194c60
版权所有,未经许可禁止转载。转载请联系本网站获取授权。