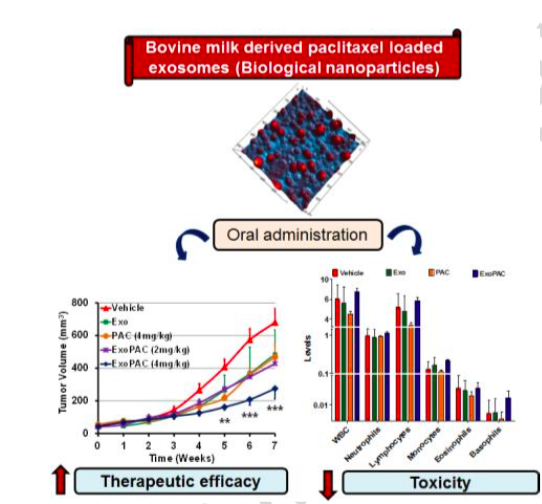
图:牛奶外泌体携带紫杉醇进行口服给药具有治疗有效性和低组织免疫毒性
紫杉烷、紫杉醇(PAC)和多西紫杉醇(DOC)代表了一类重要的抗肿瘤药物,已被证明是治疗晚期卵巢癌、乳腺癌、肺癌、胰腺癌及其他癌症的重要手段。PAC的临床应用由于其水溶性差而受到限制。尽管通过使用50:50的Cremophor EL(CrEL)和乙醇的混合物能够克服这个限制提高紫杉醇额溶解性,但是这种组合与剂量相关的毒性有关。特别是,CrEL具有生物学和药理学活性,能够引起超敏反应、高脂血症、异常脂蛋白情况、红细胞聚集,以及可能与脱髓鞘和轴索变性相关的长期不可逆的感觉神经病变。
为了克服这些局限性,Abraxane®是一种白蛋白结合的无CrEL的PAC纳米制剂,2005年被美国FDA批准生产上市;该制剂已经显示能够增强药代动力学和治疗功效。与基于CrEL的PAC相比,在转移性乳腺癌妇女的III期临床试验中,基于Abraxane®的PAC表现出更强的反应性和更长的肿瘤进展时间。虽然,Abraxane®已经表现出一些优于CrEL-PAC的优点,但其会造成白细胞和红细胞显著减少,这也是常规静脉注射药物的一个局限性。口服治疗是一种有希望规避静脉注射治疗缺点的好方法,能够提高药物使用的灵活性,减少住院服务相关的医疗资源,提高生活质量。PAC的口服治疗似乎不存在静脉治疗的一些局限性,但由于PAC非常低的水溶性(〜0.4μg/ mL),小肠中首次代谢和β-糖蛋白介导的外排、生物利用度差是PAC口服的主要障碍。
在这项发表在Nanomedicine杂志的研究中,来自美国路易斯维尔大学的研究人员利用牛奶来源的外泌体通过口服来递送化疗药物PAC,成为了一种新型纳米递送技术。外泌体是存在于所有生物流体中的生物囊泡,尺寸范围为30-100nm,并且越来越多的研究开始探讨外泌体作为递送载体的潜力。在此前,有研究认为外泌体PAC制剂的鼻腔输送对转移性肺癌具有显着的疗效。然而,该研究中源自RAW 264.7细胞的外泌体的生物相容性的缺乏使得难以将这些科研结果转化为临床。牛奶提供了一种可行的替代方案,作为具有广泛取材特点的外泌体来源,因为它具有易于推广、口服以及具有生物相容性。由于其在酸性环境中已知具有稳定性,牛奶外泌体可为紫杉烷类和其他化学治疗剂提供期望的口服药物递送载体。
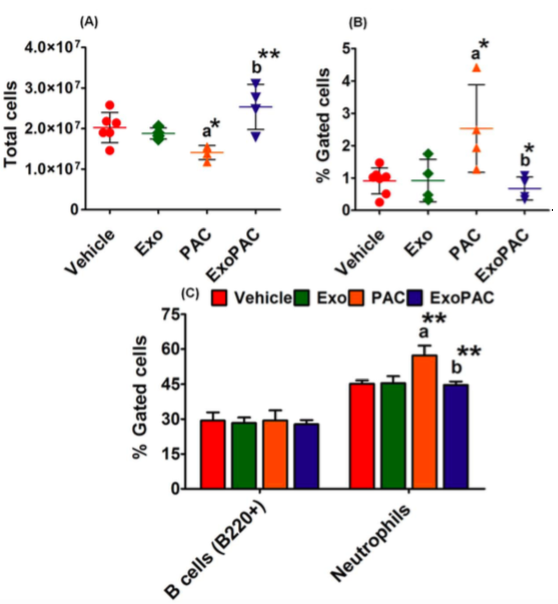
图:外泌体紫杉醇(ExoPAC)对骨髓细胞具有显著的低毒性
因此,在本研究中,研究人员开发了PAC(ExoPAC)的牛奶外泌体制剂,其特征在于能够模拟生物液体的稳定性、储存稳定性、体外释放、抑制肿瘤生长和毒性特征。这是使用牛奶来源外泌体进行PAC的口服用药并进行详细毒性分析的第一项研究。
参考文献:Agrawal AK, Aqil F, Jeyabalan J, Spencer WA, Beck J, Gachuki BW, Alhakeem SS, Oben K, Munagala R, Bondada S, Gupta RC. Milk-derived exosomes for oral delivery of paclitaxel. Nanomedicine. 2017 Jul;13(5):1627-1636.