肝脏中各种不同细胞均可分泌细胞外囊泡(EVs)。EVs在肝脏疾病中的病理生理作用日益受到重视,包括酒精性肝病、非酒精性脂肪性肝病(NAFLD)、病毒性肝炎和肝细胞癌。细胞外膜泡可以提供肝脏和其他器官之间的不同细胞类型之间的通信。细胞外膜泡具有作为疾病的生物标志物、治疗靶标和治疗传递载体的潜力。来自马萨诸塞大学医学院的研究人员在近期的Nature reviews. Gastroenterology & hepatology发表综述,回顾了EVs在肝脏疾病中作用的进展,并讨论了它们在生物标志物发现和治疗中的应用。
Key points:
- 细胞外囊泡(EVs)由肝脏中各种类型细胞分泌到细胞外空间和循环中
- 脂质双层膜包被,EVs的成分包含蛋白质、脂质和核酸
- EVs的成分代表了其来源细胞的状态;成分可以根据细胞的刺激状态和/或分化阶段而改变
- EVs作为疾病的生物标志物被研究,也可能作为治疗的靶点和载体
- EVs可通过特异性受体和细胞吸收与肝脏中的不同细胞相互作用
- 在酒精性肝病、NASH、病毒性肝炎、药物性肝损伤和肝细胞癌中发现循环EVs的水平上升
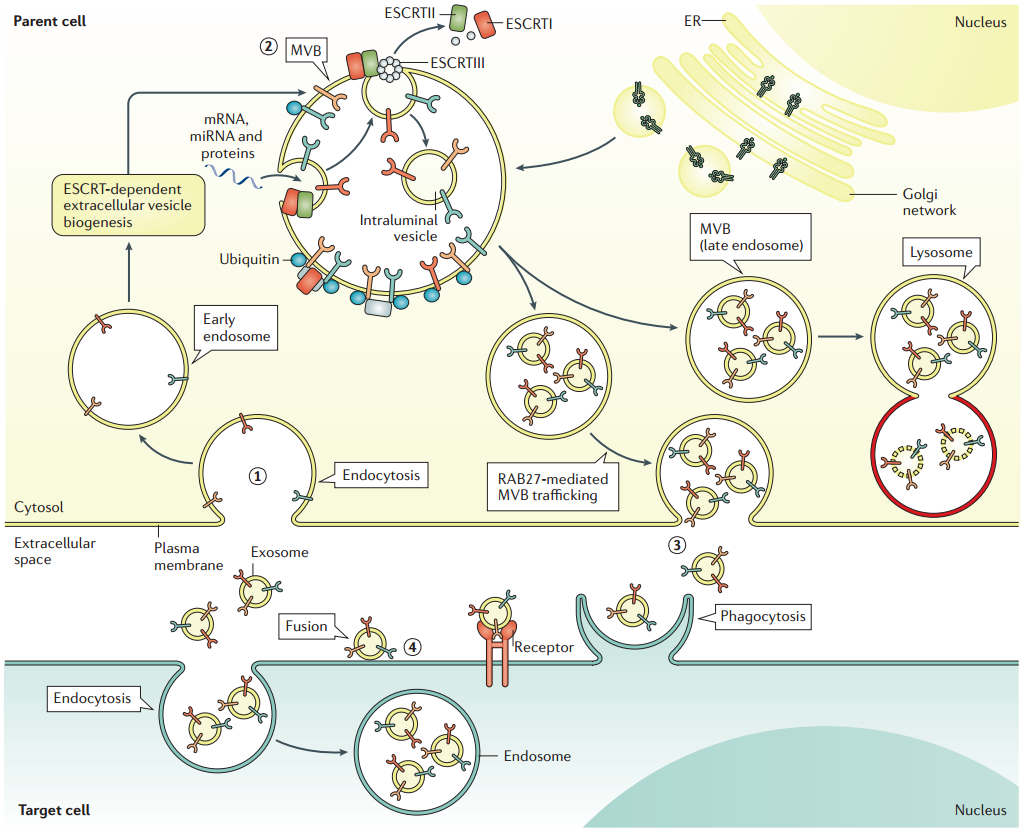
图1:细胞外囊泡生物发生和释放。早期内体是质膜内吞作用而形成(1)。RAB5和RAB3介导早期内体的形成。早期内体成熟到多泡体(MVB)(2),导致外泌体的形成。运输所需的内体分选复合物的组分(ESCRT)复合物参与MVB和外泌体生物发生。RAB27蛋白促进MVB的运输并对接到质膜上,导致MVB胞吐和外泌体释放(3)。靶细胞对外泌体的摄取主要由内吞作用介导,也可以通过与靶细胞质膜融合或吞噬作用来介导。膜结合蛋白也促进外泌体摄取和信号转导(4)。
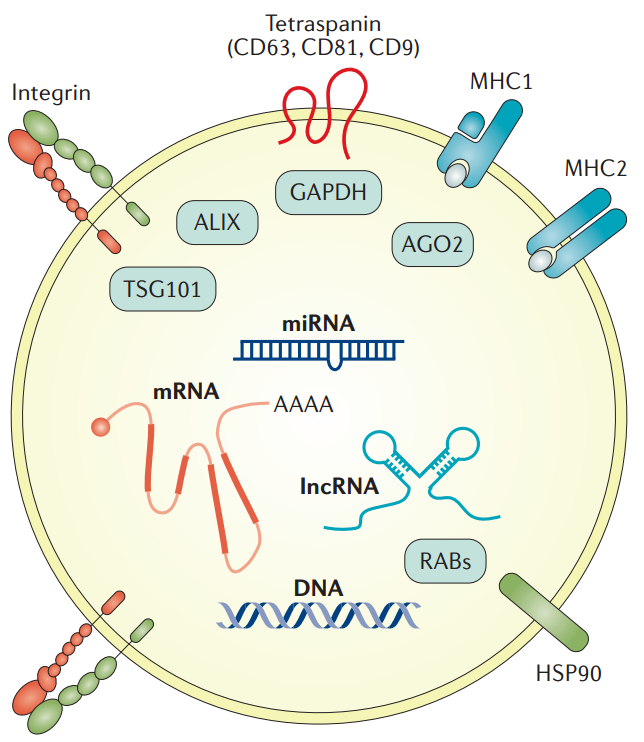
图2:外泌体组成。外泌体的示意图及其分子组分实例。
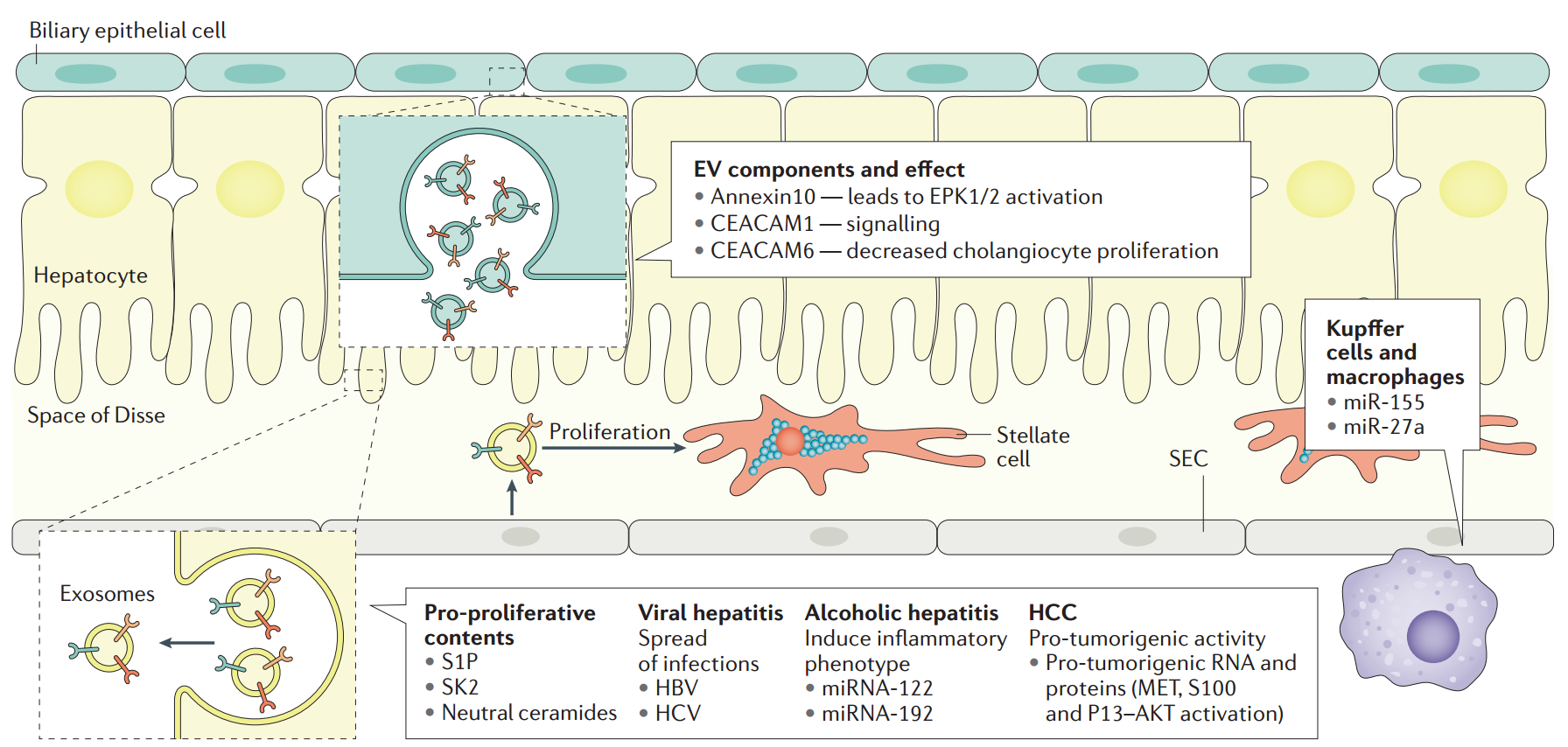
图3:肝脏生理和病理学中细胞外膜泡的生物发生和功能作用。胆的细胞外囊泡(EVs)可以在各种信号通路中发挥功能作用,包括激活蛋白激酶和减少胆管细胞增殖。由肝细胞分泌的外泌体诱导肝再生的增殖功能,并在感染病毒性肝炎的传播中起作用。在酒精性肝炎中,肝细胞衍生的外泌体含有不同微小RNA(miRs)诱导过度炎症表型。在肝细胞癌中,外泌体显示与肿瘤进展相关的促癌活性。
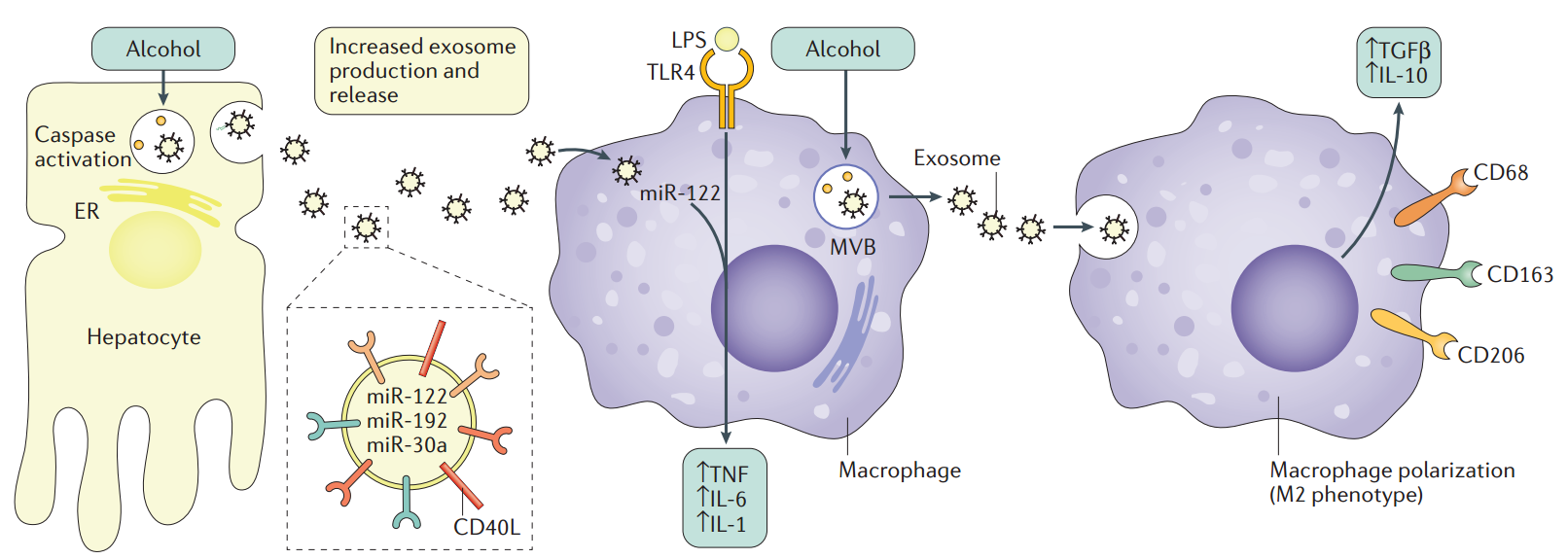
图4:外泌体在酒精性肝炎发病机制中的作用。乙醇诱导肝细胞分泌含有较高水平的微小RNA(miR)-122,miR-192和miR-30a的细胞外囊泡(EV)的增加。酒精可以激活控制炎症和细胞死亡的细胞调控网络,包括caspases,其可导致凋亡途径的激活和外泌体产生的增加。miR-122使巨噬细胞对脂多糖(LPS)刺激敏感,并诱导增强的促炎症状。酒精增加EV的分泌,由幼稚单核细胞吸收并诱导M2巨噬细胞表型,如M2表面标志物(CD68,CD163和CD206)、IL-10和转化生长因子-β(TGFβ)水平升高。来自肝细胞的EV含有CD40L,并且在被单核细胞吸收后,这些EV促进巨噬细胞活化,导致酒精性肝炎的炎症。
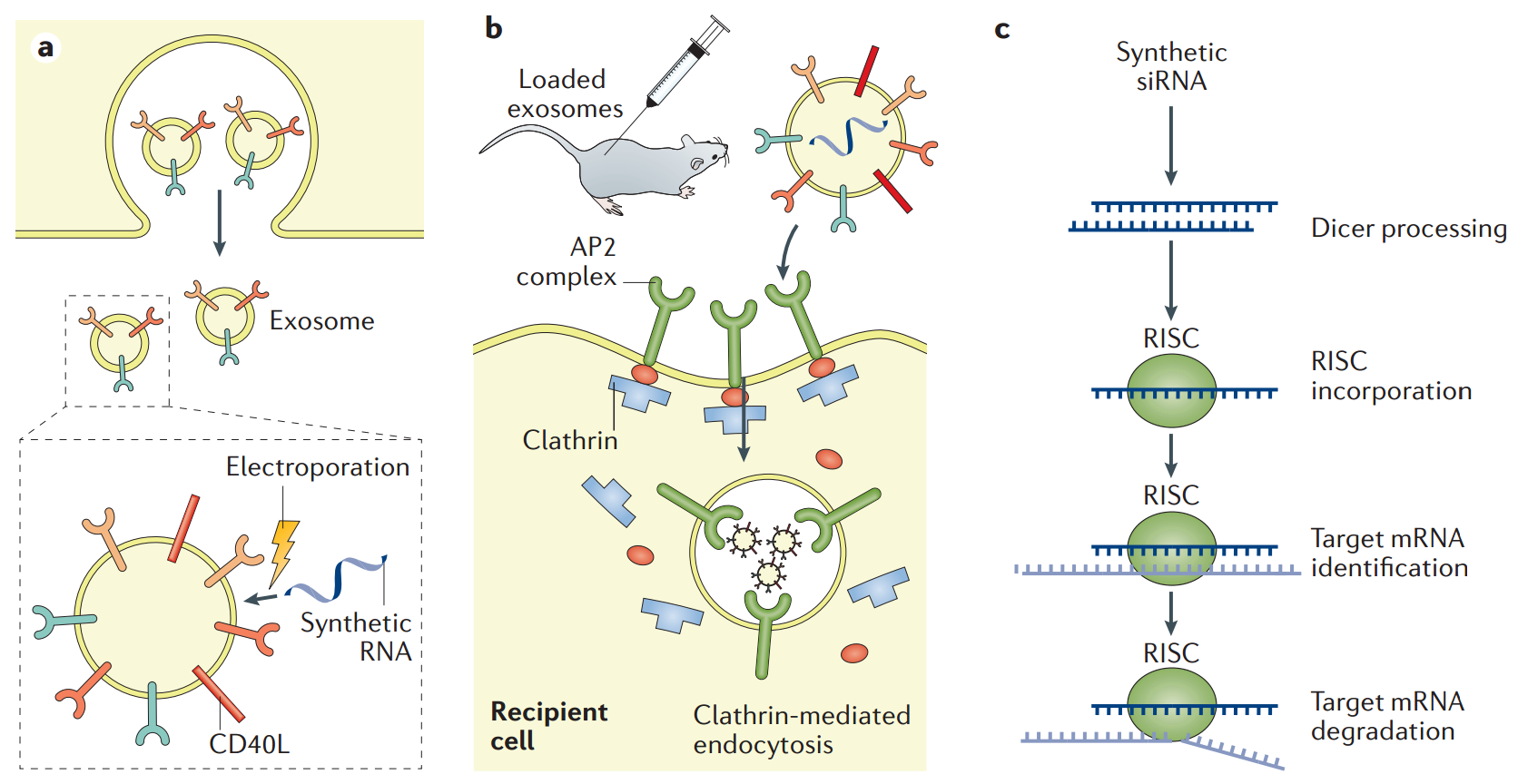
图5:外泌体用于递送RNA干扰治疗剂。a | 合成干扰RNA(RNAi)可以通过电穿孔引入外泌体。外泌体载入药物的方案需要在应对目标、成分和模型方面进行优化。加载后,应重新分离外泌体,如有必要,应建立RNAi的负载效能评价并进行优化。b | 注射的外泌体可以通过网格蛋白介导的内吞作用被不同的肝细胞吸收。靶向基团的引入(例如将APOE引入外泌体脂质双层以更快速和靶向递送到肝细胞)可以促进特异性肝细胞对外泌体的摄取。细胞摄取后,外泌体可以递送货物。c | 外泌体将合成的RNAi货物运送到细胞。转移的RNAi可以使用宿主细胞RISC复合物或外泌体递送的RISC复合物诱导靶mRNA的降解或切割。
参考文献:
Szabo, G. and F. Momen-Heravi (2017). "Extracellular vesicles in liver disease and potential as biomarkers and therapeutic targets." Nat Rev Gastroenterol Hepatol. IF= 13.678
原文PDF下载:http://www.exosome.com.cn/thread-1670-1-1.html?_dsign=3db1d0e6




