今天我们谈谈目前研究领域的一大新秀---细胞外囊泡(EVs),一种广泛存在于循环体内的细胞分泌的膜性纳米级微粒。说起囊泡,本君不得不再道一下囊泡的坎坷生世,别看现在囊泡集万千宠爱与一身,但是在囊泡发现初始,并没有受到重视,研究者将其视为细胞代谢的垃圾;随着对囊泡的认识不断深入,发现其具有重要的物质运载和信息传递作用,不仅参与心血管、肿瘤、神经系统等各大疾病的发生发展,而且可作为疾病的潜在生物标记物,用于疾病的早期非侵入性诊断以及预后观察等。
分离细胞外囊泡是研究囊泡的第一步也是至关重要的一步,只有得到纯度高的EVs,去除蛋白质、核酸、非靶-EVs等干扰物,才能进行下游的物质结构和功能的分析,但是国际上还没有制定标准的分离方法,各商家借此契机,“各显神通”,已有公司研发出专门的商品化试剂盒:加入特定EVs沉淀剂,使用普通离心机即可分离出EVs,简便快速;此外,也有研究者使用免疫亲和法,该法建立在单克隆抗体基础上,并加入抗体(anti-PSMA)标记的生物素和链霉素包被的磁珠,能高效特异地分离出表达前列腺特异性膜抗原(PSMA)的EVs(如图一)。
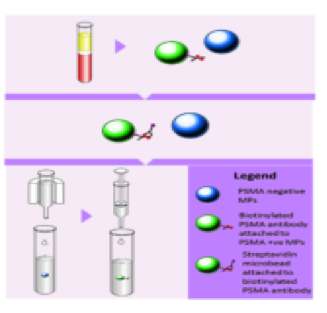
图 一: 蓝色微粒不表达PSMA;绿色微粒表达PSMA;结合有生物素标记anti-PSMA的微粒;结合有链霉素包被磁珠的微粒
为比较各方法的特异性和纯化度,Sabine I. Brett等使用不同方法制备EVs:3种试剂盒(ExoQuick Kit、ExoSpin Kit、Total Exosome Kit),免疫亲和法,然后通过原子力显微镜(AFM)和纳米级流式细胞仪(NFC)从不同方面验证并分析分离纯化的EVs。
NFC对分离纯化后的囊泡进行多参数、高通量的定量分析。首先利用硅胶纳米颗粒描绘出粒子大小校准图(如图二);然后加入荧光素,对图像进行设门选出特定区域,分别以长角度散射光和荧光为横、纵坐标表示粒子的分布情况,红色区域(PE)代表为靶-EVs(100-250nm),下方的蓝色区域(FITC)为其他EVs(如图三);最后通过靶-Evs占总-Evs的比例比较各方法的纯化度(如图四):A表示免疫亲和法制备出的Evs,B-D表示三种试剂盒制备出的Evs,很明显,A中红色区域比例较大,大小分布在100-250nm之间,并且红色区域外的EVs较少,表明免疫亲和法分离特异性高,纯度高,能有效去除干扰物。
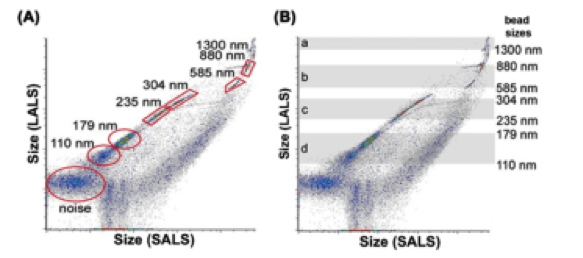
图 二:NFC测得不同大小的硅胶纳米颗粒长(LALS)-短(SALS)散射光校准示意图
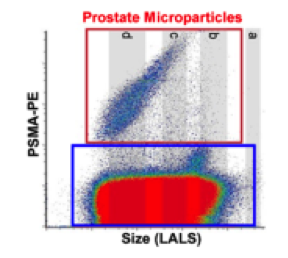
图 三:NFC测定前列腺细胞分泌的EVs示意图,以LALS为横坐标表示EVs大小(从左到右依次增加),已荧光素为纵坐标表示EVs上PSMA的表达量(从下到上依次增加),红色(PE)框内代表靶-EVs,蓝色(FITC)框内代表非靶-Evs。
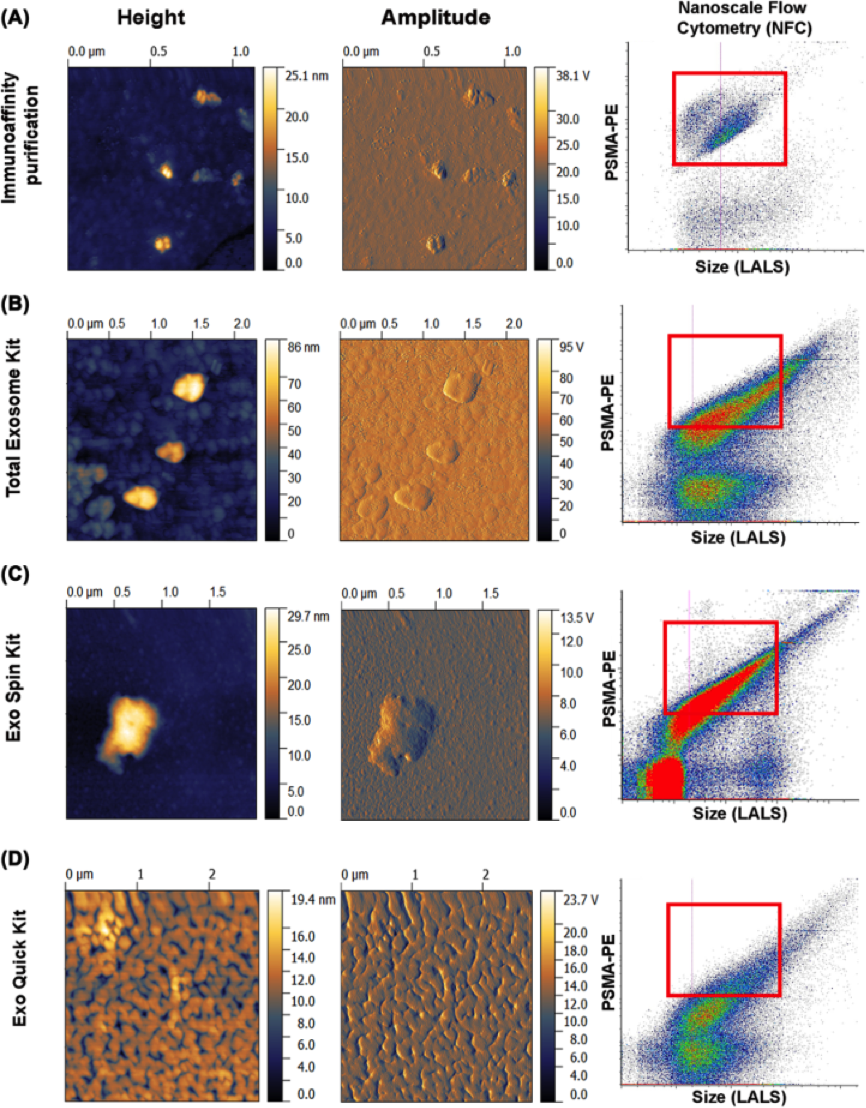
图 四: 不同方法制备的EVs的AFM(左)和NFC(右)图。A为免疫亲和法,B-D为试剂盒
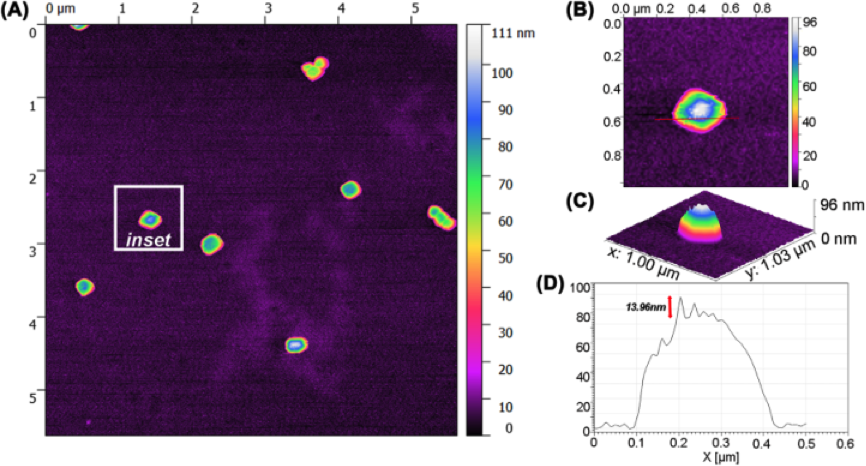
AFM以纳米级分辨率获得固体材料表面形貌结构信息及表面粗糙度信息,是目前唯一能从形态上区分EVs和干扰物(如蛋白质),通过定量分析粒子的高度与宽度得出其大小和形态(如图五)。AFM结果显示,由免疫亲和法制备的EVs高度大于100nm,其中的蛋白质高度小于10nm(如图四A),两者具有明显差别;而试剂盒制备结果不理想,大部分粒子高度低于100nm并混有大量蛋白质(如图四B-D)。
图 五: 免疫亲和法制备纯化的前列腺细胞分泌的EVs的AFM示意图。A表示EVs的一维高度与宽度;B表示单个EV的二维图像;C表示单个EV的三维图像;D表示单个EV的扫描图谱,各图表明EVs的直径为100nm左右。
虽然使用试剂盒制备EVs简便快速,但是其分离纯度低,不能去除EVs中的一些可溶性蛋白质、核酸、非靶EVs等干扰物,影响下游的分析工作,特别蛋白质组学分析;相比之下,免疫亲和法利用抗原抗体的特异性和磁珠高效分离性质,达到极高的分离纯度,有效除去蛋白质等干扰物;但是该方法具有一定的局限性,其一制备出亲和力高的单克隆抗体成本较大,其二该实验的设备(AFM、NFC)并不是所有实验室都具备,很难广泛应用于基础研究。最后,不得不说一句:每个以成形的方法都有其优缺点,至于使用何种方法来完成实验,要从多方面考虑,选出既高效又经济的方法。
参考文献:Brett SI, Lucien F; Immunoaffinity based methods are superior to kits for purification of prostate derived extracellular vesicles from plasma samples. The Prostate; 2017 Aug 1. doi: 10.1002/pros.23393.
版权所有,未经许可禁止转载。转载请联系本网站和原作者获取授权。
外泌体资讯网 谁与争锋——囊泡分离法比较:试剂盒 AND 免疫亲和法