编者按:我们都知道,我们可以从细胞培养上清、血液、尿液等各种体液、甚至各类灌洗液中提取外泌体。那么实体组织中的外泌体如何提取呢?论坛里也常有人问,比如,
有不少同学关注这个问题(相关帖子可直接点击进入讨论)。近期,JEV杂志就发表了一篇关于脑组织中提取外泌体的详细方法,在此介绍给大家,希望关注这一方面的同学有所收获。
所有细胞均可释放包括外泌体在内的细胞外囊泡,神经系统的细胞也一样。由于其能够向近端和远端细胞递送脂质、蛋白质和核酸,外泌体在神经系统的许多疾病的进展中发挥作用。迄今为止,关于这些囊泡在健康和疾病状态中的作用的大多数分析依赖于从体外来源(例如细胞条件培养基或体液)研究囊泡。该研究采取了一个关键的方法来富集和表征人额叶皮质中的外泌体。该方法可保持囊泡及其成分的完整性,并且蛋白质组学和基因组表征证实所得细胞外囊泡确实为胞内体来源的外泌体。这种方法将使神经科学家能够获得关于大脑中外泌体的更详细信息,并探讨这种形式的细胞间通讯的作用,以及脂质、蛋白质和RNA在健康的脑功能和致病条件中的独特来源。此外,该方法在从其他组织中分离外泌体可能具有重要的用途。
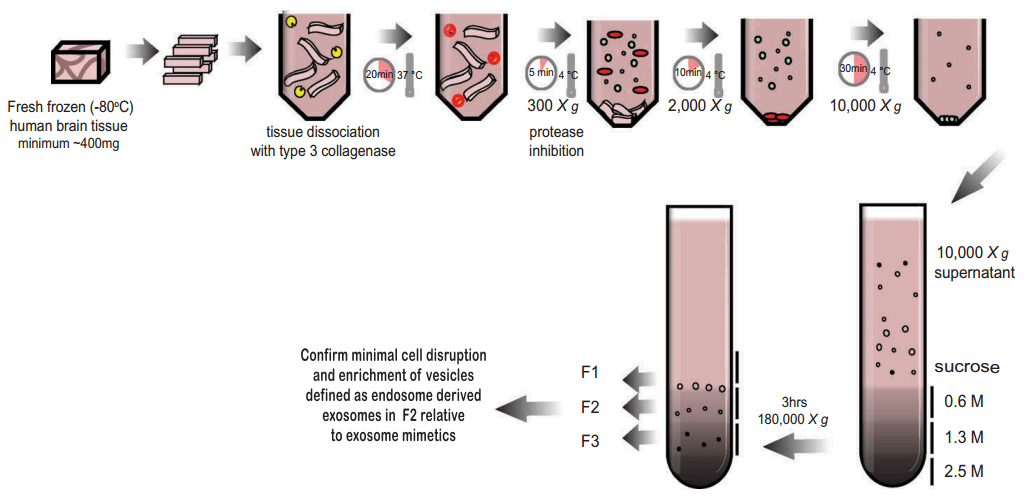
图:来自实体脑组织的外泌体分离方案示意图。用冰刀将新鲜冷冻(-80℃)人的额皮质在冰上切片,形成1-2cm长、2-3mm宽的切片。用含75 U/mL 3型胶原酶的Hibernate-E消化切片,37℃共20分钟。孵育后立即将组织返回到冰中,加入蛋白酶和磷酸酶抑制剂。将组织在4℃下以300×g离心5分钟(沉淀用作脑匀浆+胶原酶对照),将上清转移至新鲜管中,在4℃下以2000×g离心10分钟,然后在4℃下以10,000×g进行30分钟。将含EV的上清液铺在三蔗糖垫(0.6M,1.3M,2.5M)上,并以180,000×g超速离心3小时,以密度分离囊泡。弃去梯度的顶部并收集如图所示的1、2和3级分,并测量折射率。将每个级分进一步100,000×g超离以沉淀每个级分中所含的囊泡。每个部分通过包括电子显微镜、RNA和蛋白质分析在内的技术来组合验证。注意:一些组织样本将不适合这种方法。验尸延误、储存时间和冻融循环次数将对组织质量产生负面影响,并导致细胞碎片和非外泌体囊泡的污染。
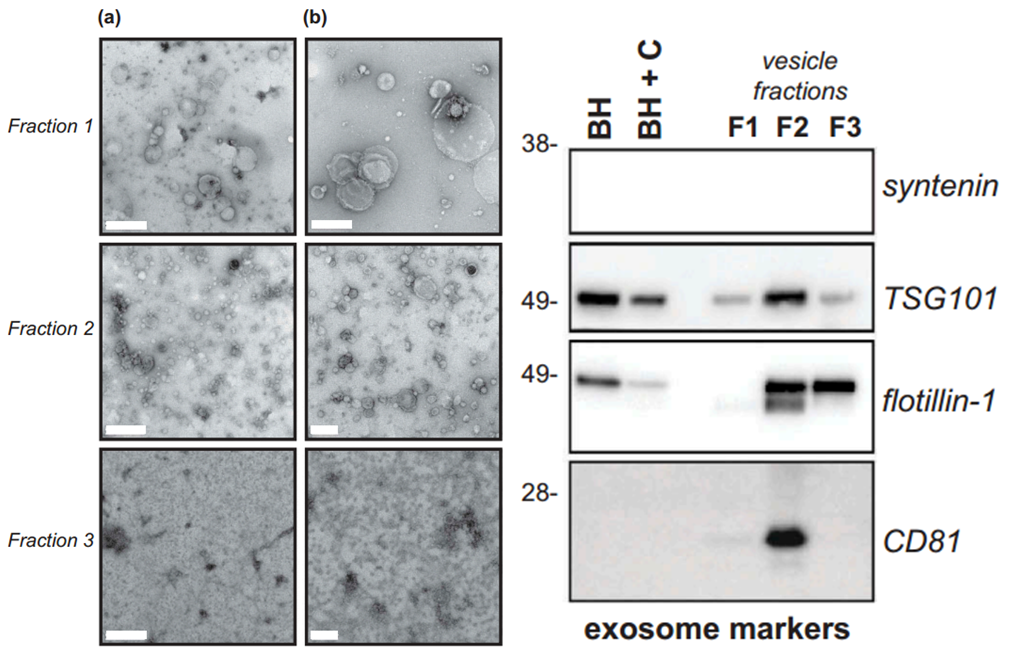
外泌体主要富集在Fraction 2部分
参考文献:
Vella, L. J., et al. (2017). "A rigorous method to enrich for exosomes from brain tissue." J Extracell Vesicles 6(1): 1348885.
文献下载:http://www.exosome.com.cn/forum.php?mod=viewthread&tid=1735&page=1&extra=&_dsign=2ecc01f8
外泌体资讯网 实体组织可以分离外泌体吗?当然可以!☟点击查看详细方法




