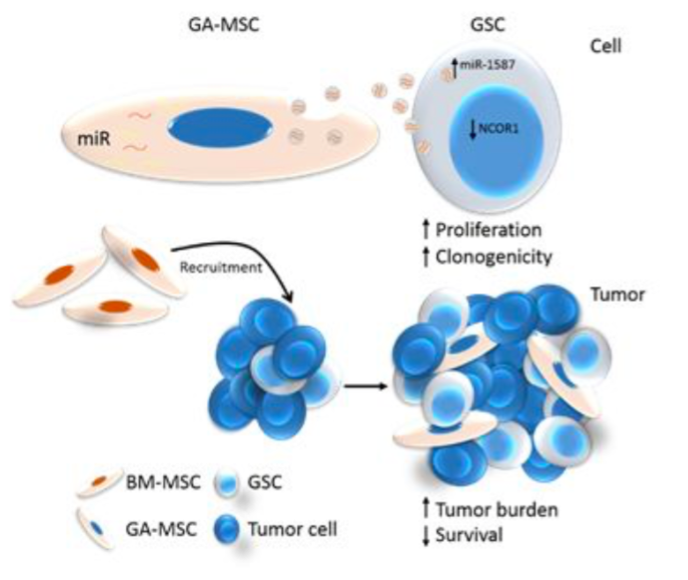
胶质母细胞瘤(GBM)是最常见的侵袭性强的原发性恶性成人脑肿瘤,尽管目前治疗方式有手术、放疗和化疗等,但GBM患者的中位生存期仅为一年左右。这种不良预后部分归因于对治疗抵抗的肿瘤起始细胞(tumor initiating cells,TIC)的细胞功能,这些细胞也被称为胶质瘤干细胞或干细胞样细胞(glioma stem cells,GSC)。GBM周围的基质构成维持GSC生存的微环境,可增强GSC的侵袭性。虽然一般认为,GBM的基质是由反应性星形胶质细胞、内皮细胞和免疫细胞组成,这些细胞都涉及到神经胶质瘤的发生,但最新研究表面,GBM中存在有类似于间充质干细胞(MSC)的基质细胞,称之为人胶质瘤相关的MSC(GA-hMSC)。有研究表面,GA-hMSCs不仅仅是胶质瘤微环境的组成部分,而且增加了体外GSCs的增殖和自我更新,增强了体内颅内模型的GSC致瘤性和间充质特性,证实了GA-hMSCs是GSC微环境内重要的细胞。GA-hMSCs分泌白细胞介素-6(IL-6),是介导GSCs增殖和干性的一种主要的细胞间通讯机制。然而,基质和肿瘤细胞之间的通讯机制是复杂的,并且可能涉及到其他因素。
由于近来研究认为,许多细胞类型会分泌、并被相邻细胞或远端细胞摄取一些纳米尺度(50-110nm直径)的脂质双层囊泡,被称为外泌体,其主要介导细胞之间的通信。这种类型的通信可以在诸如癌症的条件下被特别地利用,其中肿瘤起始细胞和周围的基质细胞可以形成相互支持的正反馈通讯机制。研究表明,癌细胞分泌外泌体中的原癌miRNA的转移可以改变非癌细胞的生物学特性,而肿瘤抑制性miRNA的转移可以抑制肿瘤生长。
外泌体在胶质瘤的研究中在此前涉及的不多。目前对于外泌体的研究着重于肿瘤细胞衍生的外泌体对基质细胞的影响。在此前一项研究中,胶质瘤细胞分泌含有mRNA和miRNA的外泌体,促进血管形成。胶质瘤的细胞外囊泡将miR-1递送至受体细胞,改变了胶质瘤细胞侵袭和增殖特性并且影响基质细胞促进内皮细管的形成。另有研究认为,GBM衍生的外泌体可将miRNA转移至小神经胶质细胞中。
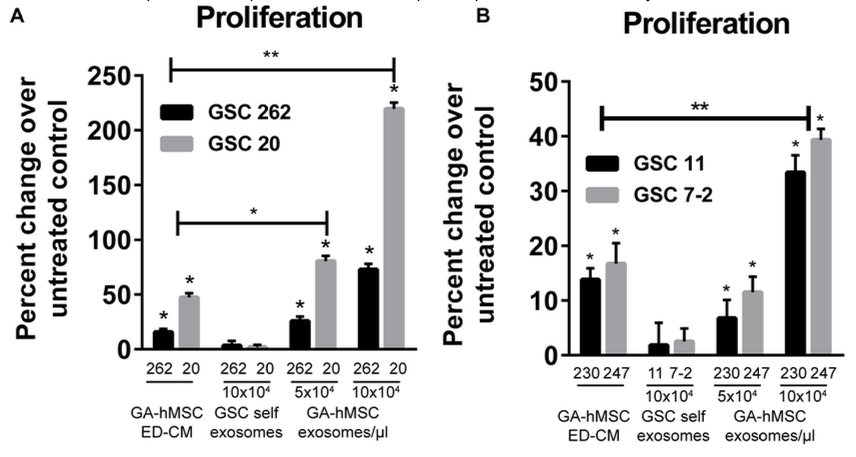
所以,肿瘤与基质间的细胞间通讯是影响肿瘤发生的,不仅肿瘤细胞能够影响基质,而且基质细胞可以通过细胞间通讯方式反向影响肿瘤细胞。在这项发表于Cancer Research杂志的文章中,来自MD安德森癌症中心Frederick Lang研究团队的研究人员认为,神经胶质瘤相关的人类间充质干细胞(GA-hMSC)————胶质母细胞瘤的基质成分,能够释放外泌体,增加肿瘤起始胶质瘤干细胞(GSCs)的增殖和克隆形成。与未被GSC处理的原位异种移植细胞相比,GSC处理后的原位异种移植物表现出更大的肿瘤负荷并降低宿主存活率。研究人员分析了外泌体内容物,鉴定出miR-1587是GSCs外泌体的作用介质,其中部分机理是可下调肿瘤抑制性核受体共抑制因子NCOR1。研究结果证明,人胶质瘤相关的MSC(GA-hMSC)能够增强胶质母细胞瘤侵袭性,其机制是通过GA-hMSC分泌的外泌体miRNA起到了肿瘤促进作用。
图:人胶质瘤相关的MSC分泌的外泌体显著增强胶质瘤细胞的增殖能力
参考文献:Figueroa J, Phillips LM, Shahar T, Hossain A, Gumin J, Kim H, Bean AJ, Calin GA, Fueyo J, Walters ET, Kalluri R, Verhaak RG, Lang FF. Exosomes from Glioma-Associated Mesenchymal Stem Cells Increase the Tumorigenicity of Glioma Stem-like Cells via Transfer of miR-1587. Cancer Res. 2017 Aug 30.