细胞外囊泡(EV),包括外泌体在内,是天然来源的纳米级囊泡,能够由许多细胞类型中产生和释放。作为细胞外实体结构,外泌体具有与相邻细胞和远端组织细胞相互作用并影响生理过程的能力,并且涉及许多疾病的发生发展,包括肿瘤发生和神经变性。外泌体也被认为可作为生物治疗药物的递送载体,这种细胞外囊泡与受体细胞相互作用以影响细胞生理学和递送大分子有效运送的方式,目前仍处于探索的早期阶段。这些研究中的一个重大挑战是,希望能够用荧光探针直接或间接标记细胞外囊泡,以便于在研究中在不影响功能的情况下实现可视化。
已经提出外泌体融合和货物释放是通过内吞作用或通过直接的外泌体-质膜融合发生的。在进行这些研究时,可以用荧光探针标记纯化的外泌体溶液,然后使用显微镜或流式细胞术来监测细胞相互作用和摄取。标记策略包括使用亲脂性染料如PKH26和碳菁染料(如DiI、DiO),它们可以以非共价方式嵌入外泌体的膜双层。然而,这种染料可以在与外泌体相似的水溶液中形成染料聚集体或团块,在外泌体摄取实验中可能会给研究人员带来误导信息。其他包括羧基荧光素琥珀酰亚胺酯(CFSE)和5,6-羧基荧光素琥珀酰亚胺基二乙酸酯(CFDA)的外泌体可渗透化合物也被用于此目的。在用这些染料标记之后对外泌体带来结构上的修饰,将改变其物理特性,但也可能影响外泌体的功能性质。对于细胞摄取分析,这种功能的影响很少被考虑到。其他标记方法包括使用融合绿色荧光蛋白(GFP)的稳定细胞系,或在外泌体中富集被标记的CD63蛋白。表达GFP的细胞产生的具有GFP标记的外泌体很难确定具体的外泌体亚群。对于过表达CD63的细胞系,已知CD63在这些囊泡的生物发生和功能中是一种重要的蛋白质,因此这些细胞产生的外泌体的组成成分将发生改变。此外,像CD63这些外泌体膜蛋白也存在于生物体液中的膜碎片、各种形式的细胞碎片和大囊泡上,因此不能完全满足对严格的外泌体纯化的需要。
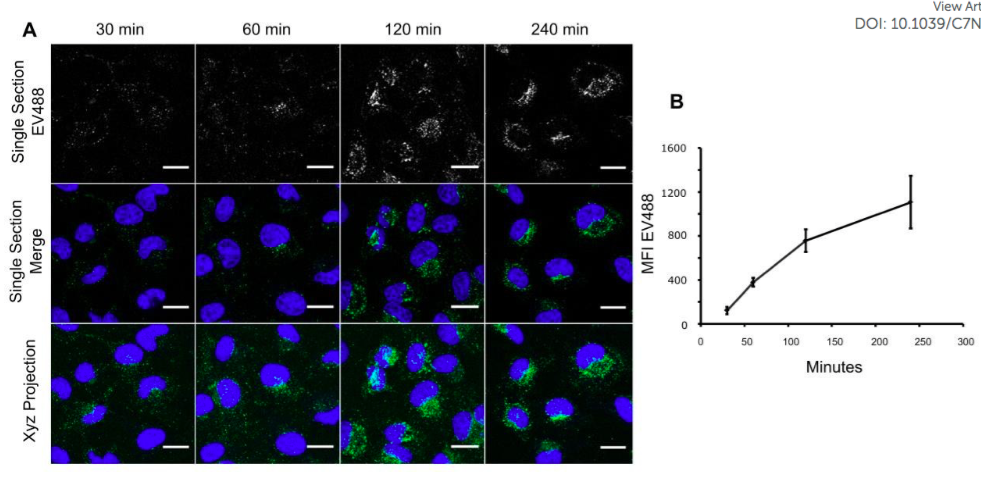
在这项发表于Nanoscale杂志的研究中,研究人员提出了一种基于硫醇(thiol)基团的荧光标记方法,可通过共焦显微镜综合分析活细胞中前列腺癌来源的细胞外囊泡的细胞摄取。以这种方式标记的EV并不影响EV的大小,并且该方法对EV诱导肺成纤维细胞向肌成纤维细胞分化的能力没有影响。对于胞吞作用分析结果表明,通过敲除关键内吞蛋白以及使用内吞作用的化学抑制剂(Dynasore,EIPA,Rottlerin和IPA-3),流相内吞作用和巨胞饮作用参与到了EV的摄取过程中。研究人员观察到,内吞作用发生6个小时后,EV与溶酶体越来越多地出现共同定位,表明这可能是外泌体内吞作用的终点。总体而言,外泌体作为影响细胞和全身生理学的细胞外实体以及药物递送载体,这种方法为分析外泌体的细胞动力学提供了新的见解。
图:maleimide-Alexa488染料结合EV硫醇基团,实现EV内吞作用的可视化
参考文献:Roberts-Dalton HD, Cocks A, Falcon-Perez JM, Sayers EJ, Webber JP, Watson P, Clayton A, Jones AT. Fluorescence labelling of extracellular vesicles using a novel thiol-based strategy for quantitative analysis of cellular delivery and intracellular traffic. Nanoscale. 2017 Sep 7.