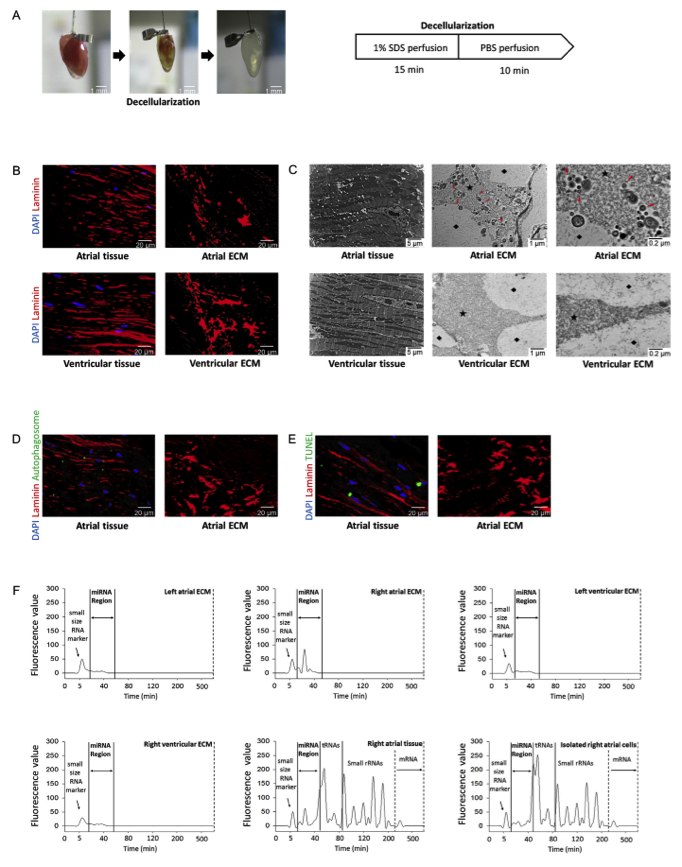
细胞外基质(ECM)在为心脏组织的适当再生提供必要的微环境中起关键作用。然而,导致ECM介导的心脏再生的具体机制尚不清楚。为了阐明潜在的机制,研究人员使用电子显微镜研究了心脏ECM的超微结构。有趣的是,从脱细胞右心房观察到大量微囊泡。RNA和蛋白质分析显示这些微囊泡含有外泌体蛋白和miRNA,研究人员将其称为ECM衍生的细胞外囊泡(ECM-EVs)。来自ECM-EVs的特异性miRNA miR-199a-3p通过抑制同源域纯蛋白(HOPX)表达和增加GATA结合蛋白4(Gata4)乙酰化促进分离的新生心肌细胞和窦淋巴结细胞的细胞生长。为了确定机制,研究人员敲除了Gata4,并证明了miR-199a-3p的作用需要Gata4作用于分离的新生心肌细胞和窦淋巴结细胞中的细胞增殖。为了进一步探索这种miRNA的作用,分离出新生心脏细胞,并将其种到心房ECM中,这里称为工程化心房。miR-199a-3p介导心肌细胞和窦淋巴结细胞群的富集,并且改善了工程化心房中窦淋巴结细胞的心电图信号活性。重要的是,miR-199a-3p的antagomir能够消除工程心房中miR-199a-3p的这些作用。进一步研究显示Ang II输注的窦性淋巴结功能障碍动物模型中,miR-199-3p处理的心脏细胞显著改善并恢复了电活动。总之,这些结果提供了ECM关键作用的明确证据,不仅提供了心脏组织生长的支架,而且通过ECM衍生的miR-199a-3p促进心房电生理功能。
首先,在脱细胞的心脏(将心脏的细胞去除,仅留下细胞外基质成分,ECM)中发现了大量的微小囊泡(EVs)和miRNA成分。
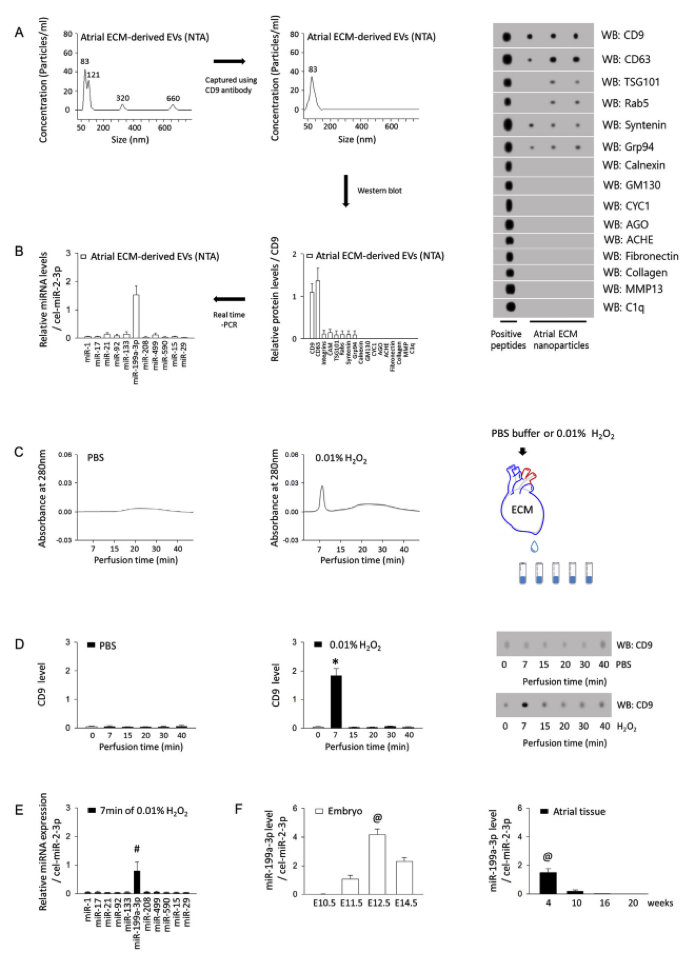
ECM-EVs的分析。使用超速离心机和CD9抗体介导的捕获从心房ECM分离纳米囊泡,并用纳米粒子跟踪分析(NTA)测定。并分析了捕获的纳米囊泡中的蛋白质和miRNA。在用PBS或0.01%H2O2灌注到心脏ECM中后,收集冠状流出液,并在每个管中记录280 nm的吸收峰。Western印迹显示在H2O2灌注7分钟时检测到CD9蛋白水平。检测了来自洗脱溶液的EVs衍生的miRNA谱和来自4至20周龄小鼠心脏各阶段和心房组织的胚胎中miR-199a-3p水平。
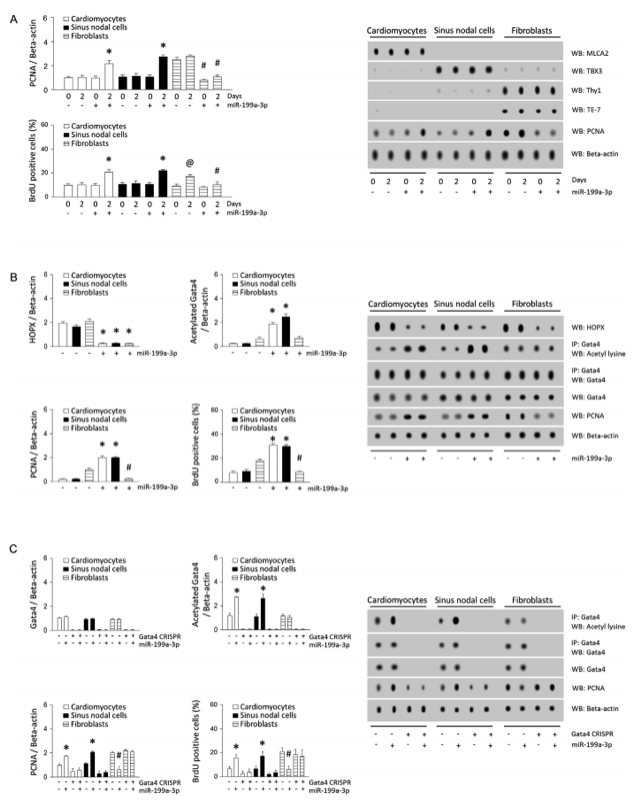
miR-199a-3p通过Gata4乙酰化介导新生心肌细胞和窦淋巴结细胞的增殖。
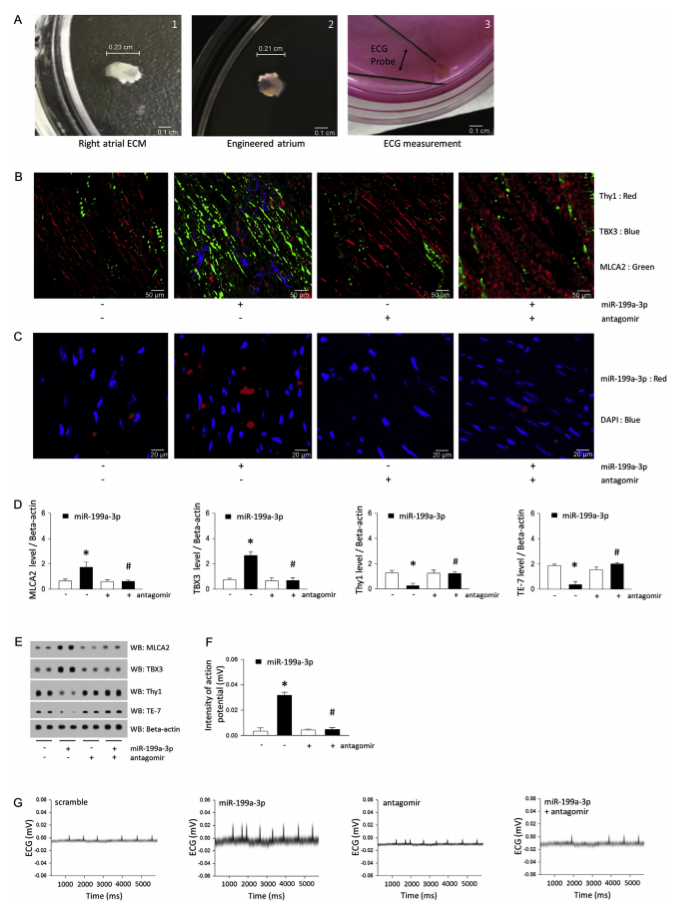
miR-199a-3p处理的工程化心房(将分离的新生心脏细胞种到心房ECM中)中的细胞类型和ECG信号分析
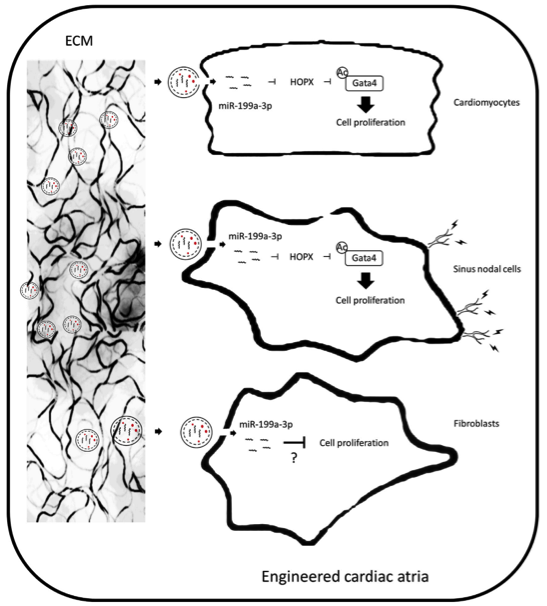
miR-199a-3p在工程化心房中的作用工作模式图。与新生心肌细胞和工程化心房中的窦淋巴结细胞相比,心脏成纤维细胞具有高增殖率的倾向。然而,通过抑制HOPX蛋白表达,心房ECM衍生的miR-199a-3p可以通过Gata4乙酰化的机制优先加速新生心肌细胞和窦淋巴结细胞而不是成纤维细胞的增殖,从而改善工程心房中心肌细胞的电活动和生长。
参考文献:
Minae An, Kihwan Kwon, Junbeom Park, Dong-Ryeol Ryu, Jung-A. Shin, Jihee Lee Kang, Ji Ha Choi, Eun-Mi Park, Kyung Eun Lee, Minna Woo, Minsuk Kim, Extracellular matrix-derived extracellular vesicles promote cardiomyocyte growth and electrical activity in engineered cardiac atria, Biomaterials, Volume 146, 2017, Pages 49-59, ISSN 0142-9612, httpdx.doi.org10.1016j.biomaterials.2017.09.001.
文献下载:http://www.exosome.com.cn/thread-1753-1-1.html?_dsign=2877fea9