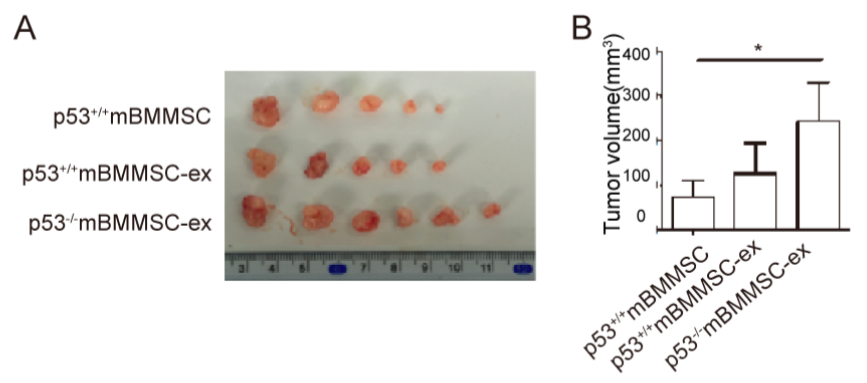
图:p53缺陷小鼠的骨髓间充质干细胞外泌体促进肿瘤生长。
胃癌是全球第五大恶性肿瘤并且是癌症死亡的第三大原因。胃癌诊断和治疗方法逐年在进步,但对患者进行早期诊断依然存在不足,而且胃癌的5年生存率仍为5-15%左右,因此研究胃癌发展相关的新分子和分子机制至关重要。近来越来越多的研究证据表明,间充质干细胞(MSC)在调节胃癌发生中发挥重要作用。
MSC是具有自我更新和多向分化能力的多能干细胞。骨髓间充质干细胞(BM-MSC)可以从骨髓转移到损伤和炎症状态下的损伤部位,对局部微环境作出反应,发挥免疫抑制和抗炎症作用。此外,MSC还可以参与肿瘤微环境的形成并与癌细胞相互作用。 MSCs在癌症中的作用近年来受到广泛关注。MSC有利于肿瘤的发生、发展、转移、侵袭和耐药。
P53是肿瘤抑制基因和转录因子。近50%的人类癌症常出现p53的突变或缺失,包括胃癌、黑色素瘤、肝癌、卵巢癌、结肠癌、白血病和淋巴瘤。研究表明,MSC的p53功能异常可促进骨肉瘤的发展。所以p53可以调节肿瘤微环境中的MSC的功能,然而,其机制在此前并不清楚。
外泌体是一种是小的(30-150nm)脂质双层膜囊泡,起源于细胞内,其含有许多生物活性分子,包括蛋白质、脂质、mRNA和非编码RNA。最近,新出现的证据表明,MSC和癌细胞释放的外泌体能够转移生物活性蛋白质,是肿瘤发生和发展的重要机制。富含EGFRvIII、血管生成素、IL-8和VEGF的成胶质细胞瘤细胞外泌体可促进内皮细胞的细胞生长和微管形成。胃癌细胞分泌的外泌体可将TGF-β转移至MSC,诱导肌成纤维细胞分化,促进血管生成和侵袭。但是,由MSC分泌的外泌体是否会受到p53的影响,则仍需进一步探索。
E3泛素-蛋白质连接酶UBR2是N端规则(N‐end rule,与蛋白质稳定性相关)的一个组成部分,其通过N端规则在肿瘤进程中发挥关键作用,可导致蛋白质泛素化和降解。来自江苏大学钱晖、许文荣实验室的蛋白质组学分析证实,UBR2在人脐带间充质干细胞来源的外泌体(huMSC-ex)中发挥作用。因此,研究人员认为UBR2在BMMSC-ex中表达较高,并且可能在胃癌进展中起关键作用。
胃癌是一种多因素肿瘤,在细胞学和遗传学上比其他胃肠道肿瘤更具异质性。在此前研究中,认为Wnt/β-catenin信号通路在许多胃癌患者中被下调,导致炎症增加、异常细胞凋亡、异常上皮细胞增殖/分化和EMT。然而,对UBR2和Wnt/β-catenin信号通路之间的联系的完整机制尚不清楚。
9月12日,来自江苏大学医学院钱晖、许文荣的研究团队在Stem Cells杂志上发表论文,在体内和体外胃癌进展中就p53缺陷小鼠的骨髓间充质干细胞(p53-/- mBMMSC)分泌的富含UBR2外泌体的调控进行了研究。研究发现p53-/- mBMMSC外泌体的浓度明显高于p53野生型小鼠骨髓间充质干细胞(p53+/+ mBMMSC)。特别是,UBR2在p53-/- mBMMSC细胞和分泌的外泌体中高表达。P53-/- mBMMSC外泌体富集的UBR2可以被p53+/+ mBMMSC和MFC(小鼠前胃癌)细胞摄取,诱导UBR2在这些细胞中的高表达,提高细胞增殖、迁移和干细胞相关基因的表达。在机制上,UBR2在p53-/- mBMMSC外泌体中的下调可逆转这些作用。在MFC中敲低UBR2后,多数Wnt家族成员、β-catenin及其下游基因(CD44、CyclinD1、CyclinD3和C-myc)均显着降低,然而敲除β-catenin后再进行UBR2敲除,Nanog、OCT4、Vimentin和E-cadherin的表达则无明显变化。总之,研究结果表明,p53-/- mBMMSC外泌体可以通过调节Wnt/β-catenin途径将UBR2递送到靶细胞并促进胃癌生长和转移。
参考文献:Mao J, Liang Z, Zhang B, Yang H, Li X, Fu H, Zhang X, Yan Y, Xu W, Qian H. UBR2 Enriched in P53(-/-) mBMMSC-Exosome Promoted Gastric Cancer Progression via Wnt/β-catenin Pathway. Stem Cells. 2017 Sep 12.