当使用传统基于物理原理的纯化方法从血浆中分离细胞外膜泡时,人们经常忽视或没有意识到脂蛋白和细胞外囊泡(EVs)一起共沉淀的问题。这个问题最终导致关于这些生物纳米颗粒的组成和生物功能的错误结论。研究人员在最新一期的Circ Res杂志上发表文章,强调了EVs和脂蛋白之间的生物物理相似性以及它们在血浆中的不同丰度,从而导致这两个不同成分被无意识地混杂在一起了。这种成分的混杂会导致我们在分析我们的目的样本时,不管是EVs还是脂蛋白,得到的质谱检测(MS)、定量聚合酶链反应(qPCR)的数据和某些载脂蛋白的动力学有关数据并不准确。
相关名词释义:
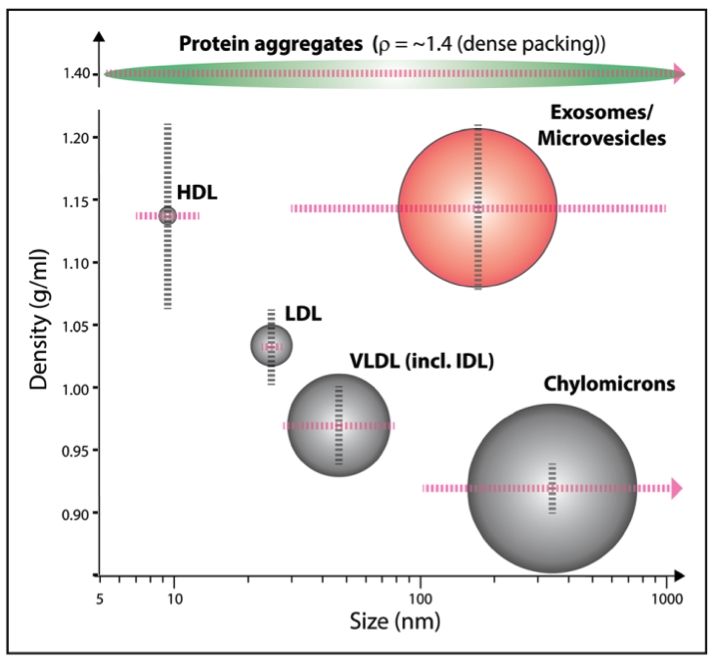
EV:细胞外膜泡(extracellular vesicle)
HDL:高密度脂蛋白(high-density lipoproteins)
LDL:低密度脂蛋白(low-density lipoproteins)
SEC:分子大小排阻色谱(size-exclusion chromatography)
VLDL:极低密度脂蛋白(very low-density lipoproteins)
图:细胞外膜泡与脂蛋白的物理特性示意图 灰色纵向的虚线代表各类别的密度范围,粉红色横向的虚线代表它们在对数标尺上相应的大小范围。此外,蛋白聚合物也在图中标示了,因为它们同样有可能混杂在样品中
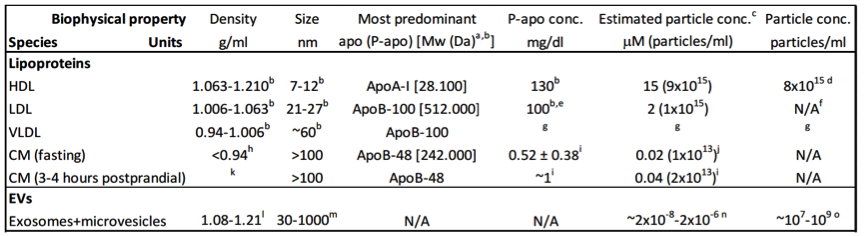
表:人血浆中不同种类脂蛋白和细胞外膜泡的生物物理数据列表
作者建议当使用基于物理的方法分离EVs或脂蛋白时,在使用仅基于大小的分离方案后,再使用基于质量密度的方法进行纯化,或者反过来也行。通过这2个步骤可得到无脂蛋白的EVs或无EVs的脂蛋白样品,至少相互污染减小到最低。但是彻底的纯化方案可能会导致与这些生物颗粒弱结合的颗粒和分子的一些损失。应该注意的是,密度梯度离心引入高剪切力,在某些情况下高盐浓度可能会破坏HDL和EVs蛋白质相互作用。重要的是,由于与血液中的EVs相比,脂蛋白的丰度高得多,所以纯度问题在EVs分离中比脂蛋白分离更为显著。作者还要强调使用定量蛋白质组学和qPCR研究来评估观察到的分子发现的意义的重要性。按照这些方面,基于蛋白质水平的脂蛋白和EVs之间的区别受到挑战,因为缺乏独特的EVs生物标志物和某些载脂蛋白的动力学特征。与乳糜微粒(apoB-48)和VLDL/LDL(apoB-100)相关的大的不可更换的apoB变体是特异性的,因此可以作为有价值的脂蛋白生物标志物。值得注意的是,作者称其不太会使用可交换的apoA-I作为HDL的生物标志物。非脂质血浆apoA-I由于其动力学性质和结合人造囊泡的能力而可能与EV相关联。他们实验室正在研究这个有趣的问题。同时,具有膜跨越特征的CD9、CD63和CD81蛋白质经常在EV中高丰度观察到可能是EVs而不是脂蛋白特异的。
作者期望这篇文章能够提供对分离纯化EVs或脂蛋白样品的挑战的认识,并强调在对EVs和脂蛋白的分子组成和生物学功能作出结论性陈述时需要谨慎。 此外,这项工作还将鼓励和指导进一步研究,开发改良的、新型的生物纳米颗粒分离和表征方法和方案,以确保我们知道当我们研究纯化的EVs和脂蛋白血浆样品时我们到底看到的是什么、研究的是什么。
参考文献:
Simonsen, J. B. (2017). "What Are We Looking At? Extracellular Vesicles, Lipoproteins, or Both?" Circ Res 121(8): 920-922. IF= 13.965
外泌体资讯网 你提取的是外泌体吗?要知道一些脂蛋白和外泌体一样大哦