外泌体正在成为应用于各种不能用常规药物治疗疾病的有效治疗工具。这些纳米级尺寸的囊泡由不同类型的细胞分泌,并通过与受体细胞膜的融合从而将其内容物(遗传信息和蛋白质)递送至受体细胞中,来参与细胞间的通讯。因此,外泌体可以作为一种强大的用于药物和基因治疗的转运体。间充质干细胞(MSC)来源的外泌体表现出与来源MSC类似的功能,包括靶向性和减少炎症、修复组织损伤和调节免疫系统。因此,MSC衍生的外泌体可以提供与MSC的治疗相同的有益效果,同时避免MSC移植相关的许多风险。此外,外泌体具有穿越生物屏障的内在能力,使其能够绕过血脑屏障并将负荷物有效地运输到大脑中。因此,基于外泌体的无细胞治疗有可能为各种疾病特别是脑病变提供治疗。
然而,利用MSC衍生的外泌体用作治疗剂之前,还需要阐明各种问题,包括外泌体追踪和通讯机制以及外源性外泌体的体内生物分布和药代动力学。成像模式可以提供有关这些问题的重要信息。最近的研究已经证明了在体内成像分析外泌体的能力,主要是使用各种光学设备,并且主要用于癌症研究。然而,最常见的荧光和光学成像模式在深部脑结构内去图像化外泌体的能力是非常有限的。
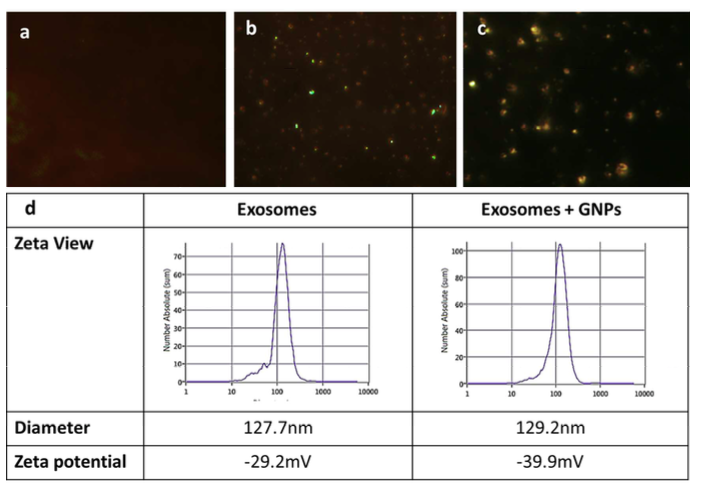
图1:葡萄糖包被的金纳米颗粒能够增强外泌体的标记效果
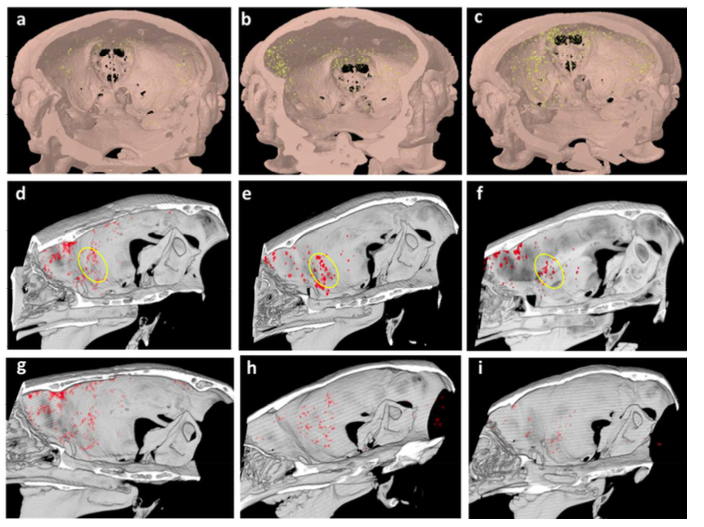
在这项发表于ACS Nano的研究中,来自以色列特拉维夫大学的研究人员建立了一种基于葡萄糖包被的金纳米颗粒(glucose-coated gold nanoparticle,GNP)标记和计算机断层扫描成像(CT)的非侵入性体外神经成像和追踪外泌体的方法。外泌体与GNP的标记是直接实现的,而不是通过亲代细胞的低效的典型间接标记模式。在机制上,研究人员发现葡萄糖包被的GNP进入MSC衍生的外泌体中是通过葡萄糖转运蛋白GLUT-1和诸多内吞蛋白质介导,这是一种激活的能量依赖性机制。接下来,研究人员确定了大小和技术路线的最佳参数,证明5 nm的GNP能够增强外泌体标记,与静脉注射相比,鼻内给药表现出更好的脑积累效果,从而增强体内的神经成像。此外,利用局灶性脑缺血的小鼠模型,研究人员在鼻内给予GNP标记的外泌体进行非侵入性追踪。结果显示,相同时间内与对照组正常大脑组织的非特异性迁移和清除相比,在24小时内病变的大脑部位表现出GNP外泌体的积累增加。因此,这种外泌体标记技术可以作为各种脑疾病的强大的诊断工具,并且可能潜在的改善基于外泌体的神经元恢复治疗方法。
图2:小鼠脑中风模型中,病变脑区(图a-f)的GNP外泌体的积累量明显多于正常对照组(图g-i)。
参考文献:Betzer O, Perets N, Angel A, Motiei M, Sadan T, Yadid G, Offen D, Popovtzer R. In Vivo Neuroimaging of Exosomes Using Gold Nanoparticles. ACS Nano. 2017 Oct 5. doi: 10.1021/acsnano.7b04495.