干细胞疗法可对受损的心脏组织进行修复和再生,然而移植的干细胞的低存活率限制了干细胞的治疗功效。外泌体可以通过介导细胞之间的通讯来调节包括细胞生存在内的多个细胞过程。近日,来自广州医科大学附属第二医院的刘世明、刘宁宁课题组的研究人员在Cell Death & Disease杂志中发表文章,发现移植后的干细胞的存活率低,是因为心肌梗死细胞来源的外泌体会促进移植的骨髓间充质干细胞的损伤。
干细胞治疗心肌梗死在过去的几十年中已经引起了前所未有的关注。骨髓间充质干细胞(BMSCs)由于其易于获得、分化潜能多向、高增殖能力以及无免疫反应等独特性质,已成为用于心肌梗死移植治疗的有吸引力的细胞。尽管如此,在严苛的缺血性心脏微环境中的细胞存活率很差,限制了骨髓间充质干细胞的治疗效果,从而促使人们去寻找新的有效方法,并探索心肌梗死治疗中BMSCs的机制。目前为止,已经提出了几种方法来改善移植细胞的存活率,包括预处理、基因修饰和改善宿主组织环境等。许多细胞类型以高度协调的方式相互作用以控制心脏的完整性和稳态,包括心肌细胞、肌成纤维细胞、免疫细胞、心源性干细胞和内皮细胞。外泌体已经表现出通过介导细胞/器官之间的交流来调节多个生理生化过程,包括细胞存活、血管生成和免疫应答。虽然心肌细胞不能作为典型的分泌细胞,但外泌体可以以诱导的方式从心肌细胞中分泌出来。与营养因子和信号分子一起,心肌细胞分泌的外泌体被认为通过介导细胞间的接触对心肌起关键作用。目前尚不清楚受损的心肌细胞衍生的外泌体(心脏外泌体)是否具有影响心肌梗死后移植的BMSCs存活的能力。
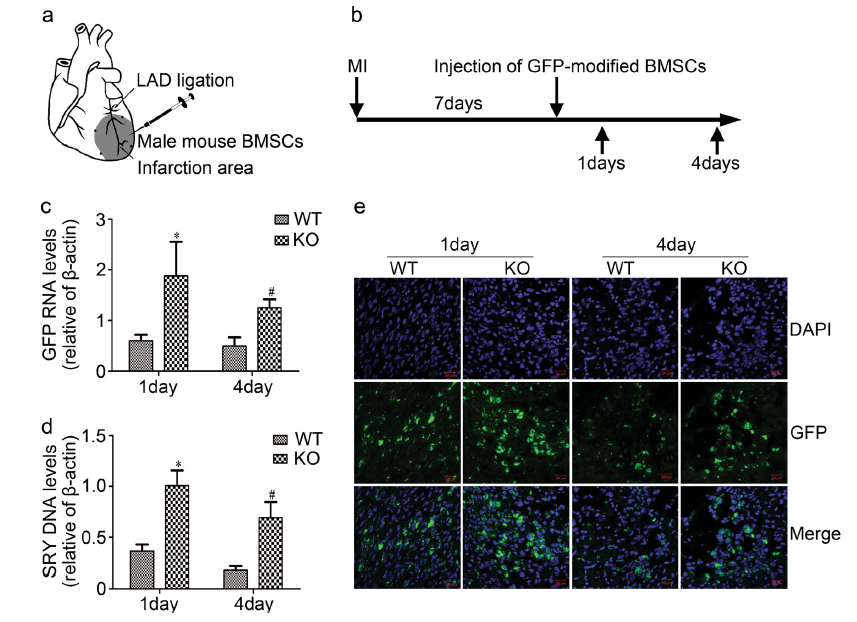
外泌体是细胞外囊泡(EV)的亚类,其来源于细胞内的多泡体中的内部囊泡,并且它们的大小通常在40至200nm范围内。当多泡体与质膜融合时,外泌体组成性地释放到细胞外环境中。 Rab蛋白,一种GTP酶家族,在功能上参与细胞内膜运输的不同步骤,包括内吞和分泌过程,以及外泌体产生或分泌。敲低Rab27b后多泡体会重新分布至核周区域,而晚期胞内体和溶酶体区域在Rab27a基因抑制细胞中积累并扩大。这表明Rab27a是多泡体与质膜对接和融合所必需的,并且在外泌体分泌中也很重要。为了探索心脏外泌体在体内移植的BMSCs存活中的作用,研究人员构建了Rab27a KO的小鼠模型,将GFP标记的BMSC植入Rab27a KO雌性小鼠中与梗死心肌相邻的存活心肌中。通过Y染色体Sry DNA和GFP mRNA的表达以及通过检测GFP荧光信号强度来评估移植细胞的存活情况。在该研究中,研究人员通过体外和体内实验确定了心肌梗死中的心脏外泌体对移植的BMSC的存活的影响。
研究人员对受损的心肌细胞来源的外泌体(心脏外泌体)是否影响梗死心脏中移植的骨髓间充质干细胞(BMSC)的存活进在以下几个方面进行了探究。为了模拟心肌细胞或移植的BMSCs在体内遇到的严苛微环境,将心肌细胞条件培养基和从过氧化氢处理的心肌细胞培养基中收集心脏外泌体,与氧化应激条件下的BMSCs在体外进行培养。过氧化氢诱导的心肌细胞条件培养基和心肌外泌体明显加速的BMSCs损伤;切割的caspase-3与caspase-3间的比值和凋亡百分比增加,并降低细胞中Bcl-2/Bax比例和细胞活力。接下来,研究人员通过TALEN基因组编辑技术构建Rab27a敲除(KO)的小鼠模型,探讨了心脏外泌体在体内移植的BMSC存活中的作用。Rab27a是GTP酶家族,在外泌体分泌中起关键作用。将雄性小鼠GFP修饰的BMSC植入Rab27a KO野生型雌性小鼠中的梗死相邻的存活心肌中,所得结果显示,在Rab27a KO小鼠中,Y染色体Sry DNA、GFP mRNA和GFP荧光信号强度都较高,移植的BMSC在梗死心脏中的存活增加。综上所述,这些发现揭示了受损的心肌细胞来源的外泌体促进了梗死心脏中移植的BMSC损伤,从而揭示了心肌梗死后移植细胞存活的新机制。
图:在Rab27a KO的心肌梗死小鼠模型中观测移植的BMSCs的存活情况
参考文献:Hu M, Guo G, Huang Q, Cheng C, Xu R, Li A, Liu N, Liu S. The harsh microenvironment in infarcted heart accelerates transplanted bone marrow mesenchymal stem cells injury: the role of injured cardiomyocytes-derived exosomes. Cell Death Dis. 2018 Mar 2;9(3):357.