受益于影像学和放疗的发展,鼻咽癌患者的生存率明显提高,尽管如此,远处转移仍然是鼻咽癌治疗失败主要原因。肿瘤转移依赖于血管的生成,新生血管为肿瘤细胞提供了营养和细胞转移通道,在其中miRNA参与了肿瘤血管生成的调节。近日,来自南通大学尤易文、刘东课题组的研究人员在Oncogene杂志上发表文章,发现miR-23a在转移或转移前阶段的鼻咽癌组织中高度富集,通过外泌体的转移参与调控鼻咽癌相关的血管生成。
鼻咽癌是头颈部最常见的癌症,在中国南部、北非和阿拉斯加地区发病率较高。鼻咽癌是鳞状细胞癌,因此放疗是早期的主要治疗方法,5年总生存率约84-90%。对于局部晚期鼻咽癌,化疗联合放疗的方法将死亡率降低至18%,5年总生存率提高4-6%,是标准的治疗方法。然而,鼻咽癌具有高转移潜能,并且远端转移是主要的治疗失败情况,并且鼻咽癌转移的分子机制仍不明确。
血管生成是从已有血管为起点生长的新血管,涉及许多复杂的内皮细胞活动,包括细胞增殖、迁移、侵袭、粘附和分化。血管生成在正常或病理条件下均会发生,肿瘤转移需要病理性的血管生成,通过血管能够为肿瘤细胞提供氧气、营养物或帮助细胞转移。研究肿瘤血管生成有助于提高对肿瘤转移的理解。在最近的一项研究中,转移性鼻咽癌患者的毛细血管密度(49.90±7.25)显著高于非转移性鼻咽癌患者(42.86±7.84)(P <0.05),所以鼻咽癌血管生成是个重要的研究点。
miRNA是一类小的非编码单链RNA,通过与靶信使RNA的3'非翻译区(3'UTR)结合而沉默基因表达。据估计,miRNA可调控三分之一以上的人类mRNA的产生,涉及不同的生物过程。在此前的研究中,miR-23a-27a-24-2家族介导着血管生成。他们发现,miR-23a-27a-24-2家族成员在内皮细胞和高度血管化的组织中表达较高,通过靶向Sprouty2和Sema6A蛋白抑制miR-23/27能够抑制血管生成。最近的一项研究来自描述了miR-23a的过表达减弱了TNF-α诱导的内皮细胞凋亡。鉴于血管生成是一个复杂且多步骤的过程,进一步研究miR-23a介导的血管生成调节的功能和机制十分必要。
由各种细胞(包括癌细胞、间充质细胞、成纤维细胞和免疫细胞)释放的外泌体,直径在50-150nm范围内,是一种细胞外纳米囊泡。与外泌体的来源细胞类似,外泌体包含细胞中的各种功能性生物分子,包括蛋白质、RNA和DNA。目前对于外泌体的miRNA的作用研究非常多,肿瘤细胞分泌外泌体中的miRNA可穿梭至邻近或远处的受体细胞,以发挥其对远端细胞的基因调控。
研究发现,肿瘤来源的miRNAs可以通过外泌体转运至人脐静脉内皮细胞(HUVECs)以发挥类似细胞内miRN的生物学作用。研究人员此前在血清中分离和鉴定了鼻咽癌细胞特异性外泌体,然后将它们添加到HUVEC的培养基中。结果显示鼻咽癌外泌体加速了体外和体内的血管生成。一些miRNA可能在调节血管生成过程中发挥作用。本研究的目标是来验证鼻咽癌分泌的miR-23a是否通过外泌体参与血管生成。
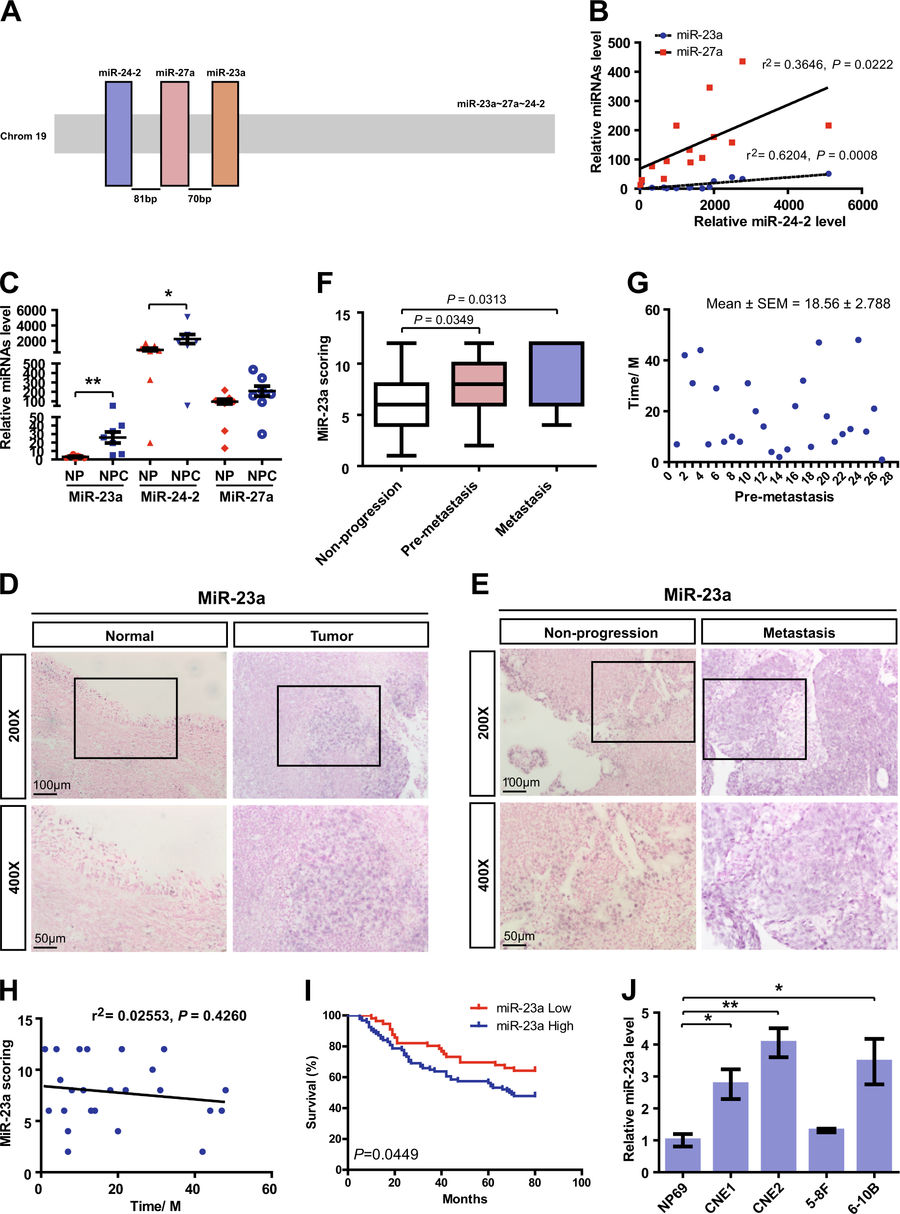
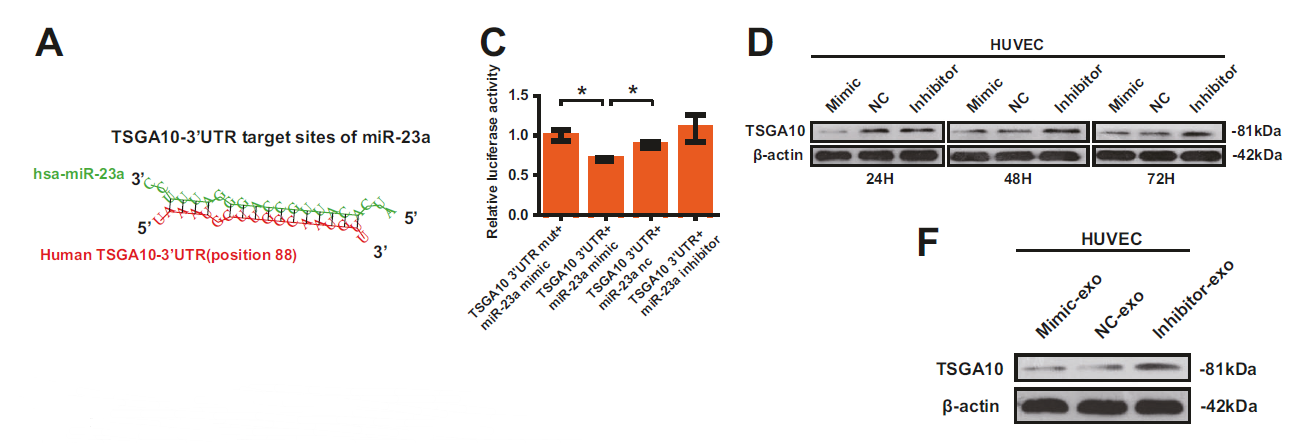
研究人员发现miR-23a在转移或转移前阶段在鼻咽癌组织中高度富集,并且其在鼻咽癌中与微血管密度相关。随后,研究人员证明了miR-23a的表达改变在体外调节了HUVEC的生长、迁移和微管形成,并且影响了斑马鱼模型中的血管生长。由于细胞外的miR-23a可能是从鼻咽癌CNE2细胞转移到HUVECs的,研究人员分析了包裹在外泌体中的miR-23a,结果显示鼻咽癌外泌体中的miR-23a的过表达促进体外和体内血管生成。此外,研究人员还提供了miR-23a通过直接靶向睾丸特异性基因抗原(TSGA10)来调节血管生成的证据。综上所述,研究结果显示来自鼻咽癌外泌体的miR-23a通过靶向TSGA10在介导血管生成促进转移的过程中起重要作用。
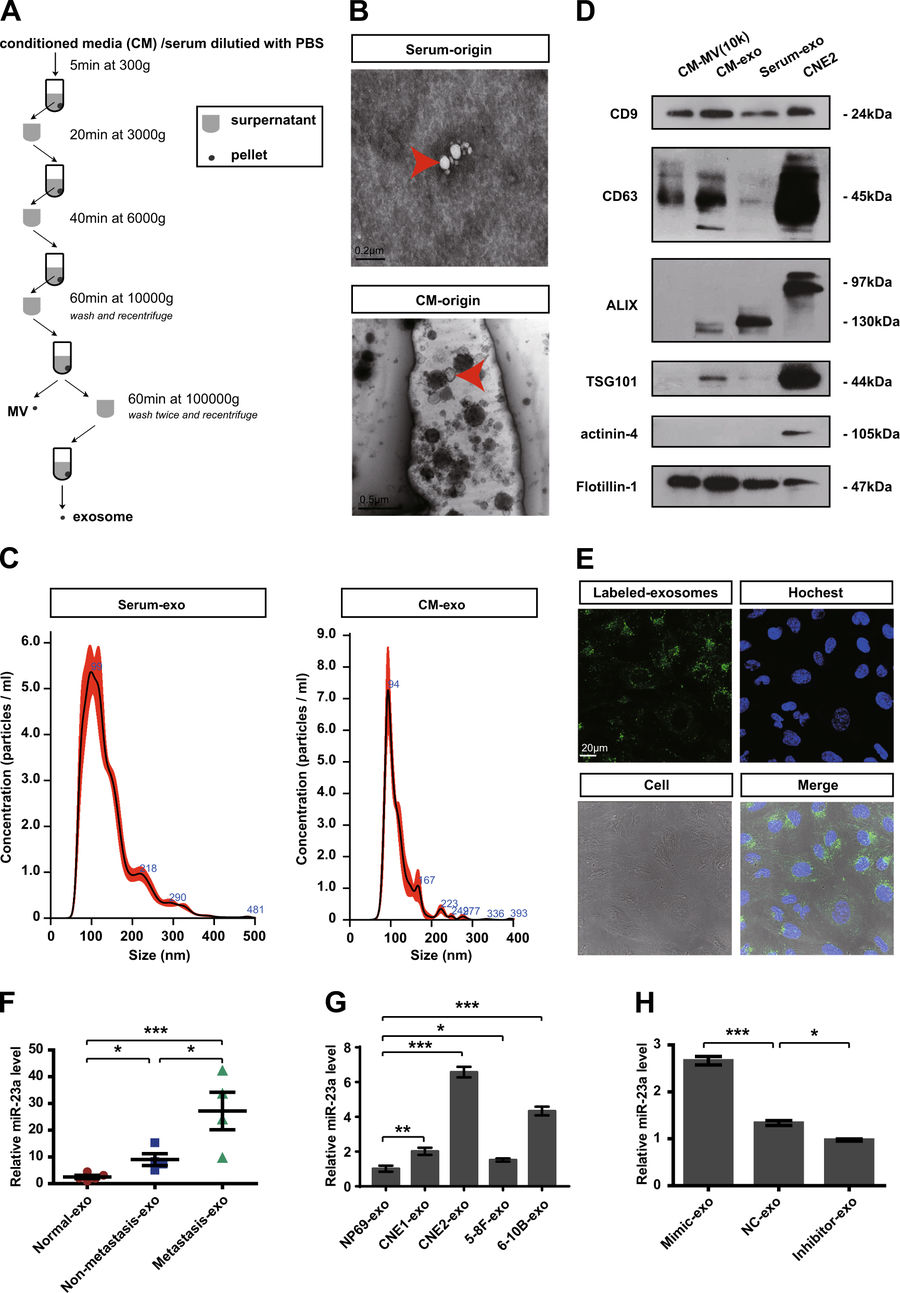
图2:MiR-23a在鼻咽癌细胞外泌体中高表达。采用传统的超速离心方法(Beckman 90Ti rotor)提取外泌体(流程如图A所示),并进行电镜、WB、NTA检测(图B-D)。图F展示转移鼻咽癌患者的血清外泌体中miR-23a表达较高。图G-H是鼻咽癌细胞系中miR-23a的表达情况。
图3:MiR-23a直接调控TSGA10 mRNA。
参考文献:Bao L, You B, Shi S, Shan Y, Zhang Q, Yue H, Zhang J, Zhang W, Shi Y, Liu Y, Wang X, Liu D, You Y. Metastasis-associated miR-23a from nasopharyngeal carcinoma-derived exosomes mediates angiogenesis by repressing a novel target gene TSGA10. Oncogene. 2018 Mar 9.