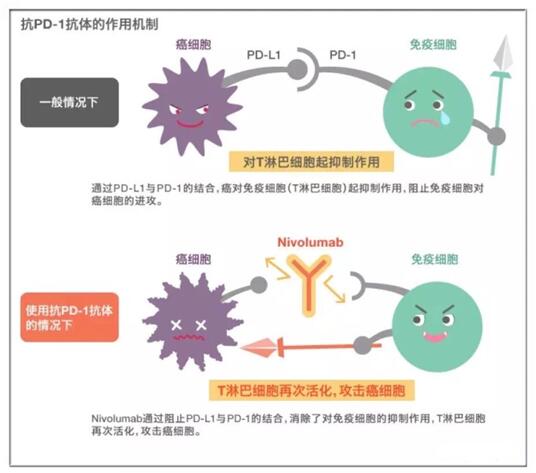
程序性死亡配体-1(PD-L1)与程序性细胞死亡蛋白-1(PD1)的结合抑制T细胞功能导致癌症免疫逃逸。胶质母细胞瘤是一种常见的致命脑癌,其特征之一是其强大的局部和全身性免疫抑制。也有研究显示胶质母细胞瘤细胞外囊泡(EVs)可能在肿瘤发展中起重要作用。因此,该研究假设胶质母细胞瘤EV可能是免疫抑制的重要介质,并且PD-L1可能在其中发挥作用。研究表明,胶质母细胞瘤EVs在T细胞受体刺激中抑制T细胞活化和增殖。PD-L1在一些(但不是全部)胶质母细胞瘤衍生的EVs表面表达,可能与PD1直接结合。当EV上存在PD-L1时,抗PD1受体阻断抗体显著逆转EV介导的T细胞活化阻断。当胶质母细胞瘤PD-L1被IFN-γ上调时,EVs也显示出一些PD-L1依赖性的T细胞活化抑制。PD-L1表达与间充质转录组特征相关,并且解剖学定位于人胶质母细胞瘤标本的坏死周边和假栅栏细胞层niche中。PD-L1 DNA存在于肿瘤体积高达60立方厘米的胶质母细胞瘤患者的循环EVs中。这些结果表明EVs上的PD-L1可能是胶质母细胞瘤抑制抗肿瘤免疫力的另一种机制,并支持了EVs作为肿瘤患者的生物标志物的潜力。
该研究思路:
- 首先发现胶质母细胞瘤EVs可以以抗原特异性的模式抑制T细胞活化;
- 发现胶质母细胞瘤EVs上含有PD-L1,并可阻断TCR诱导的T细胞激活;
- 接着证明了质母细胞瘤EVs上的PD-L1确实可以与T细胞上的PD-1结合,并且这种结合可以被抗PD-1治疗阻断;
- 进一步研究发现,PD-L1低表达的质母细胞瘤在受IFNγ刺激后PD-L1表达上调,进而细胞外膜泡上的PD-L1增多,从而抑制T细胞活化;
- RNA-seq分析发现PD-L1的表达水平与M胶质母细胞瘤和IFNγ反应基因相关;
- 临床上,来自胶质母细胞瘤病人血清和血浆的EVs含有的PD-L1 DNA水平与肿瘤的大小呈正相关。
不懂肿瘤免疫治疗的尤其是PD-1和PD-L1作用机理的小伙伴看这里↓↓↓
肿瘤免疫治疗的逻辑基础是,肿瘤的突变发生在免疫系统的监视之下。绝大部分早期的肿瘤突变确实都被免疫监视(immuno-surveillance)所清除了。这是因为,突变肿瘤中的一小部分细胞产生了一种被T细胞认为是“不是自己人”的蛋白,这类蛋白被称为“新抗原”(neoantigen),免疫监视的主要敌人就是这些新抗原。不过,肿瘤细胞亦非等闲之辈,它们自身会表达一些抑制免疫反应的分子来对抗机体对其的免疫监视,比如PD-L1、IDO、IL-10和TGFβ等。通常,这种自身免疫系统和肿瘤的激烈鏖战在体内可持续好多年,时间长了,我们自身的免疫系统就会产生一种现象,叫做T细胞耗竭(T cell exthaustion),即,T细胞表面会表达一些抑制性的分子,比如PD1、TIM3、LAG3等等,更有甚者,耗竭状态下的T细胞甚至会释放IFNγ,诱导肿瘤微环境里的PD-L1和IDO上调,让自身的免疫系统无法发挥作用、缴械投降。这种抑制性的肿瘤微环境,就是很多直接刺激肿瘤免疫反应药物无法产生作用的原因。所以这里面的关键分子PD-1和PD-L1成了目前肿瘤免疫治疗的明星靶点。
参考文献:
Ricklefs, F. L., et al. (2018). "Immune evasion mediated by PD-L1 on glioblastoma-derived extracellular vesicles." Sci Adv 4(3): eaar2766.