截止目前,发表在Nature杂志的外泌体文献共有13篇,其中10篇研究性文章,3篇综述/评述性文章。
- (2012) Zhang, G., et al. "The oyster genome reveals stress adaptation and complexity of shell formation." Nature 490(7418): 49-54.
这是一篇关于牡蛎的研究性文章。通讯作者:前华大王俊等。
该研究主要是做了牡蛎基因组测序,并揭示其应激适应和壳结构的复杂性。其中涉及,所鉴定的259种壳蛋白中的84%不是经典分泌蛋白;它们可能是细胞的一部分或被外泌体沉积而来。259个壳蛋白中的61个与外泌体数据库中的蛋白质匹配,支持了外泌体的存在。在矿化前缘处观察到含有方解石晶体的细胞和外泌体样囊泡,尽管它们在壳形成中的重要性是有争议的。这项研究为它们在壳内的存在及其可能参与壳形成提供了分子证据。
- (2014) Matusek, T., et al. "The ESCRT machinery regulates the secretion and long-range activity of Hedgehog." Nature 516(7529): 99-103.
这是一篇关于果蝇发育中Hedgehog蛋白通过ESCRT分泌到细胞外囊泡控制形态发生的研究性文章。通讯作者:Pascal P. Thérond。
Hedgehog(Hh)蛋白的保守家族作为短距离和长距离分泌的形态发生素,在胚胎发育过程中控制组织构型和分化。成熟的Hh携带疏水性棕榈酸和对其细胞外扩散至关重要的胆固醇修饰。已经有研究报道了各种Hh的胞外转运机制,但实际用于体内Hh分泌和转运的途径尚不清楚。该研究显示Hh在果蝇翅膀成虫盘的分泌依赖于运输所需的内体分选复合物(ESCRT)。在体内,产生Hh的细胞中ESCRT活性的降低导致外部细胞表面保留Hh。此外,产生Hh的细胞中的ESCRT活性对于长距离信号传导是必需的。证据表明Hh和ESCRT蛋白质的库在体内一起分泌到细胞外空间中,并且随后可以在受体细胞的表面一起被检测到。这些发现揭示了ESCRT蛋白质在控制形态发生活性中的新功能,揭示了一种新的机制,通过细胞外囊泡在组织中转运分泌的Hh,这是长距离靶向诱导所必需的。
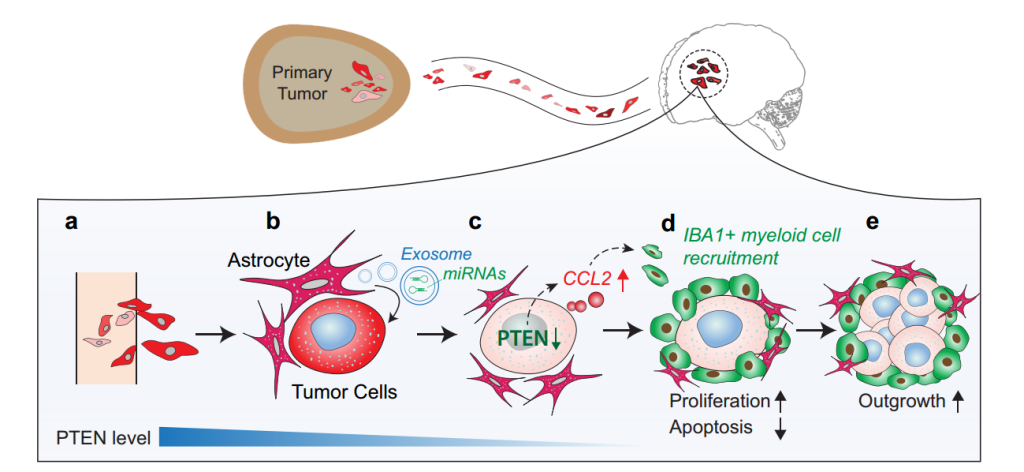
- (2015) Zhang, L., et al. "Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth." Nature.
这是一篇关于外泌体miRNA参与肿瘤转移的研究性文章。通讯作者:美国安德森癌症中心余棣华教授。
该研究揭示了正常表达PTEN的肿瘤细胞在传播到脑部后PTEN表达丢失,但是传播到其他器官后不会。在转移到脑后丢失PTEN的肿瘤细胞在离开脑部微环境后PTEN的表达水平会得到恢复。所以推断这是一种脑微环境依赖的、可逆的PTEN mRNA和蛋白下调的模式。进一步研究发现,星型胶质细胞来源的外泌体介导了与转移肿瘤细胞之间的靶向PTEN的microRNAs的传递。体内实验证明,星型胶质细胞特异性敲除靶向PTEN的microRNAs或者阻断星型胶质细胞分泌外泌体可恢复PTEN并抑制脑部的转移。此外,这种适应性脑转移肿瘤细胞的PTEN丢失导致趋化因子CCL2分泌的增加,招募表达IBA1表达的骨髓来源的细胞,从而通过增加繁殖和抑制凋亡来相互促进脑转移肿瘤细胞的生长。该研究揭示了转移肿瘤细胞的PTEN表达对不同器官微环境的显著可塑性,为转移细胞与其微环境在适应性转移生长的过程中相互影响的重要作用提供了重要的证据。该研究发现阐明了肿瘤细胞与转移微环境的动态、相互的交流的新机制,更重要的是,为抑制肿瘤转移,尤其是脑转移提供了新的策略。
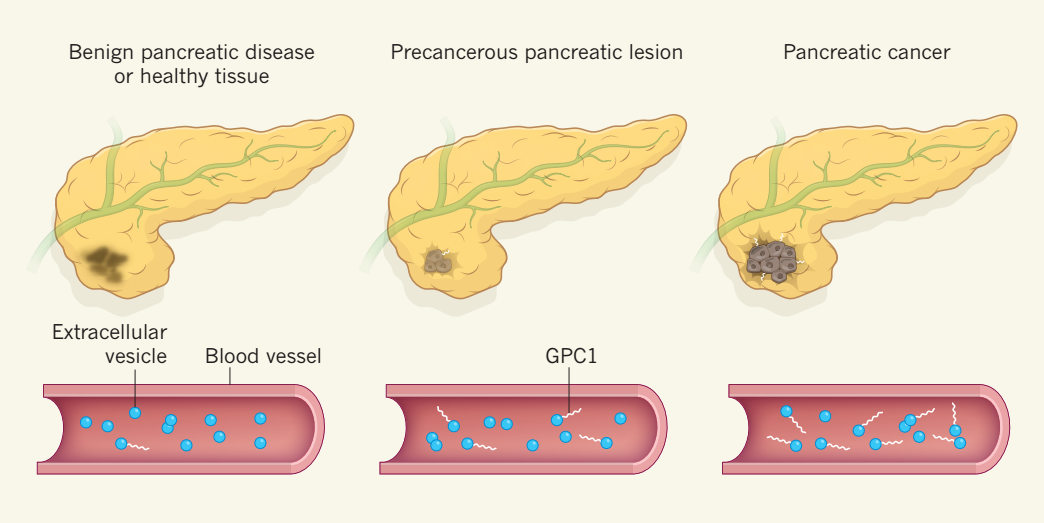
- (2015) Melo, S. A., et al. "Glypican-1 identifies cancer exosomes and detects early pancreatic cancer." Nature.
这是一篇关于利用外泌体GPC-1蛋白早期诊断胰腺癌的文章。通讯作者:MD Anderson癌症研究中心的 Raghu Kalluri。
该研究通过大量的胰腺癌病人血清样本分析发现,相较正常人而言,胰腺癌病人血清中GPC1(glypican-1)阳性的外泌体占比显著增高。进一步研究发现,GPC1阳性外泌体在早期胰腺癌病人的血清中丰度就显著高于正常人群。这一发现为胰腺癌的早期诊断提供了十分重要的依据。
- (2015) Thery, C.. "Cancer: Diagnosis by extracellular vesicles." Nature.
这是一篇针对上面那篇外泌体GPC-1蛋白早期诊断胰腺癌研究论文的评述文章。
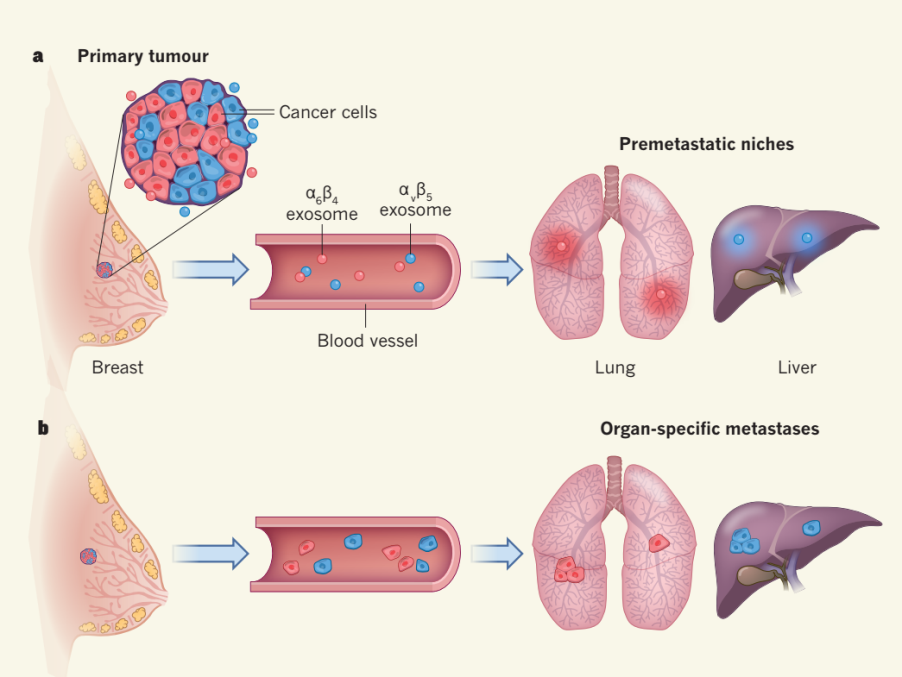
- (2015) Hoshino, A., et al. "Tumour exosome integrins determine organotropic metastasis." Nature advance online publication.
这是一篇关于外泌体整合素决定肿瘤转移器官倾向性的研究性文章。通讯作者:康奈尔大学David Lyden。
该研究表明被特定器官的细胞获取的肿瘤外泌体可为肿瘤的转移准备转移前微环境。用肺转倾向的肿瘤细胞来源的外泌体处理小鼠后可使骨转倾向的肿瘤细胞重新定向。外泌体的蛋白质组学分析发现不同器官倾向性的肿瘤细胞来源的外泌体具有不同的整合素(integrin)表达谱,整合素α6β4和α6β1与肺转有关,而整合素αvβ5与肝转有关。敲低整合素α6β4和αvβ5可减少外泌体被靶器官细胞获取,进而分别降低了肺和肝的转移。进一步研究发现外泌体整合素被细胞获取后激活了Src的磷酸化和促炎的S100基因的表达。最后通过临床数据分析显示外泌体整合素可作为预测肿瘤转移的器官倾向性的诊断指标。
- (2015) Rak, J. "Cancer: Organ-seeking vesicles." Nature advance online publication.
这是一篇针对上面那篇外泌体整合素参与肿瘤转移倾向性研究论文的评述文章。
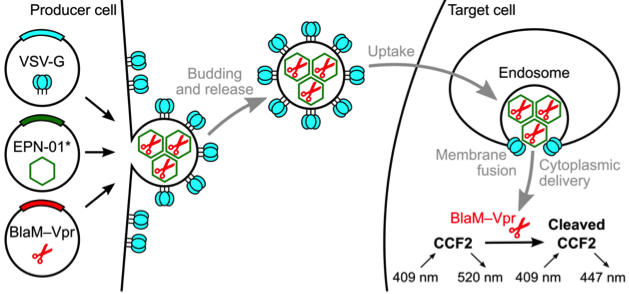
- (2016) Votteler, J., et al. "Designed proteins induce the formation of nanocage-containing extracellular vesicles." Nature 540(7632): 292-295.
这是一篇关于外泌体在药物递送方面的研究性文章。通讯作者:美国犹他大学Wesley I. Sundquist。
该研究报道了一种自组装蛋白质纳米笼(nanocages)的设计,它们以一种类似于一些病毒的方式从人类细胞释放到小囊泡中。研究人员将这种生物材料称为“包膜蛋白纳米笼”(EPNs)。EPN的生物发生需要三个不同功能的蛋白质序列元件:膜结合、自组装和转运所需的内体分选复合物(ESCRT)。具有这些功能元件的各种合成蛋白诱导EPN的形成,突出了设计策略的模块性和普适性。生物化学分析和冷冻电子显微镜显示,编号为EPN-01的设计,由含有多个蛋白质纳米笼的小(〜100 nm)囊泡组成,与60亚基自组装支架结构的设计十分匹配。掺入水泡性口炎病毒糖蛋白(VSV-G)的EPNs可以与靶细胞融合并递送其内容物,从而将货物从一个细胞转移到另一个细胞。这些结果表明蛋白质如何被编程以指导杂交生物材料的形成,并执行复杂的任务,建立EPNs作为一类设计的、模块化的,遗传编码的纳米材料,可以在细胞之间转移分子。该方法在药物递送方面有很重要的应用前景。
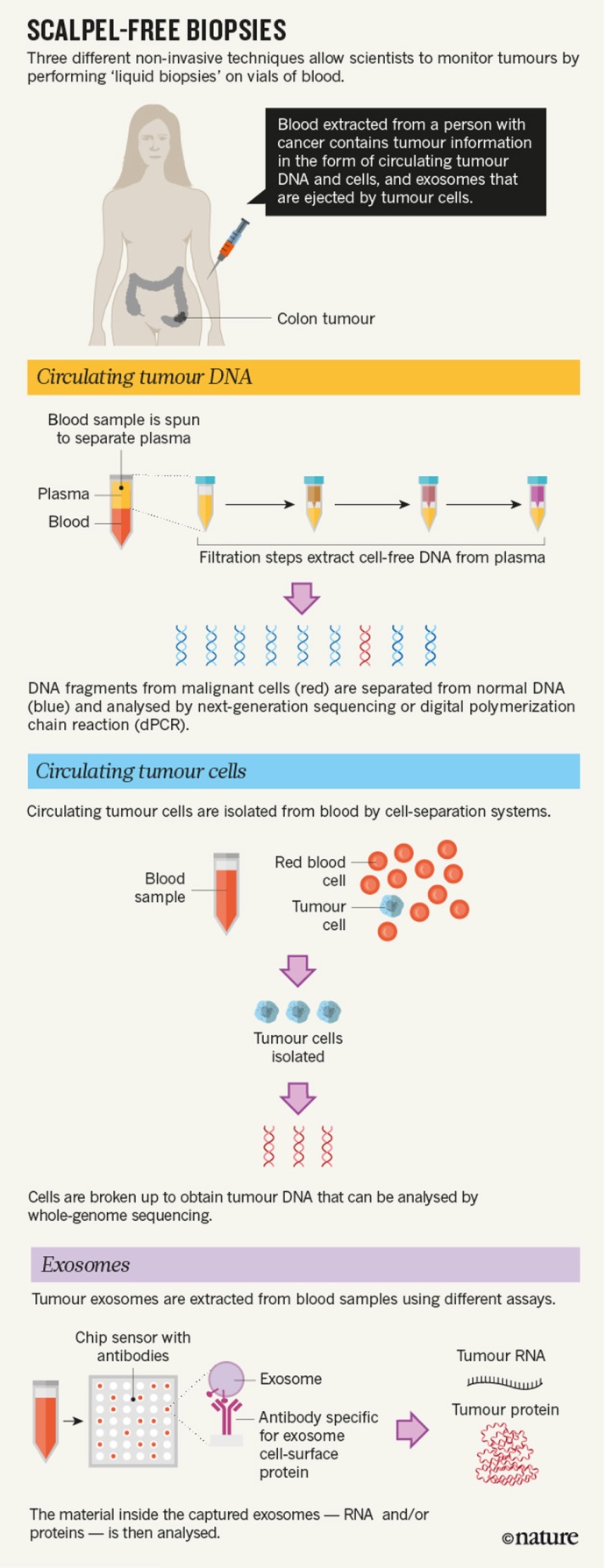
- (2016) Chi, K. R. "The tumour trail left in blood." Nature 532(7598): 269-271.
这是一篇关于液体活检的综述文章。
该综述主要从CTC、ctDNA与外泌体3方面介绍了目前液体活检的发展现状
- (2016) Han, C. Z., et al. "Macrophages redirect phagocytosis by non-professional phagocytes and influence inflammation." Nature.
这是一篇关于巨噬细胞微囊泡影响炎症发生的研究性文章。通讯作者:美国弗吉尼亚大学Kodi S. Ravichandran。
该研究发现,巨噬细胞会通过释放可溶性生长因子(即IGF-1)和微囊泡(microvesicles)来改变非专职吞噬细胞和颗粒的类型以及对炎症的反应。在吞噬凋亡细胞或响应炎症因子时,巨噬细胞会释放IGF-1。IGF-1会结合到非专职吞噬细胞表面的受体上,调节他们的吞噬作用,降低对大体积凋亡细胞的吞噬,增强对微囊泡的吞噬,同时不改变巨噬细胞的吞噬特性。巨噬细胞也会释放微囊泡,这些微囊泡会被上皮细胞等非专职吞噬细胞吞噬,从而降低炎症反应。并且,与前面所述一致,呼吸道上皮细胞表面IGF-1受体的缺失,会加重过敏原引起的肺部炎症。这些遗传学和功能学研究揭示了IGF-1及微囊泡依赖的巨噬细胞和上皮细胞的通信会影响组织炎症。
- (2017) Zhang, Y., et al. "Hypothalamic stem cells control ageing speed partly through exosomal miRNAs." Nature 548(7665): 52-57.
这是一篇关于下丘脑干细胞分泌外泌体延缓衰老的研究性文章。通讯作者:美国爱因斯坦医学院蔡东升教授。
该研究发现,随着下丘脑干细胞的消失,小鼠开始出现衰老症状。每个小鼠模型都表现出来了衰老相关的生理变化或者寿命的缩短。相反,中年小鼠中植入经过改造的健康的下丘脑干细胞/祖细胞后,小鼠的衰老症状延迟并且寿命延长,并且这些经改造后的下丘脑干细胞可以在衰老相关的下丘脑炎症微环境下存活。进一步研究发现,下丘脑干细胞/祖细胞会将外泌体miRNA分泌到脑脊液中,而这些外泌体miRNA在衰老过程中会下调,而用健康的下丘脑干细胞/祖细胞分泌的外泌体的治疗便能够减慢衰老进程。简言之,机体衰老的速度基本上是由下丘脑干细胞所控制的,而该过程一部分是下丘脑干细胞通过释放外泌体miRNA的来实现的。
- (2017) Kamerkar, S., et al. "Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer." Nature.
这是一篇关于利用外泌体作为RNAi载体靶向治疗胰腺癌的研究性文章。通讯作者:MD Anderson癌症研究中心的 Raghu Kalluri。
该研究探讨了外泌体是否可以作为RNAi的有效载体的可能性。与脂质体和其他合成药物纳米颗粒载体不同,外泌体含有可能增强内吞作用的跨膜和膜锚定蛋白,从而促进其内容物的递送。CD47是外泌体蛋白质之一,是一个广泛表达的整合素相关跨膜蛋白,其部分功能可以保护细胞免受吞噬作用。CD47是信号调节蛋白α(SIRPα,也称为CD172a)的配体,CD47-SIRPα间的结合能够发出“不要吃我”的信号,从而抑制吞噬作用。癌基因RAS能够促进胰腺癌细胞增殖,增强胞饮作用从而促进肿瘤细胞摄取外泌体。合成纳米颗粒对细胞有一定毒性作用,但使用外泌体能够最小化对细胞的毒性。研究人员发现,CD47和癌基因KRAS驱动的胞饮作用都会抑制外泌体被循环系统的清除,并增强胰腺癌细胞对外泌体的特异性。所以,外泌体的这种特性增强了它们通过递送RNAi来特异性靶向胰腺癌中的KRAS的能力,并且使用外泌体作为单一靶向剂显着改善了所有实验PDAC小鼠模型的总生存期。
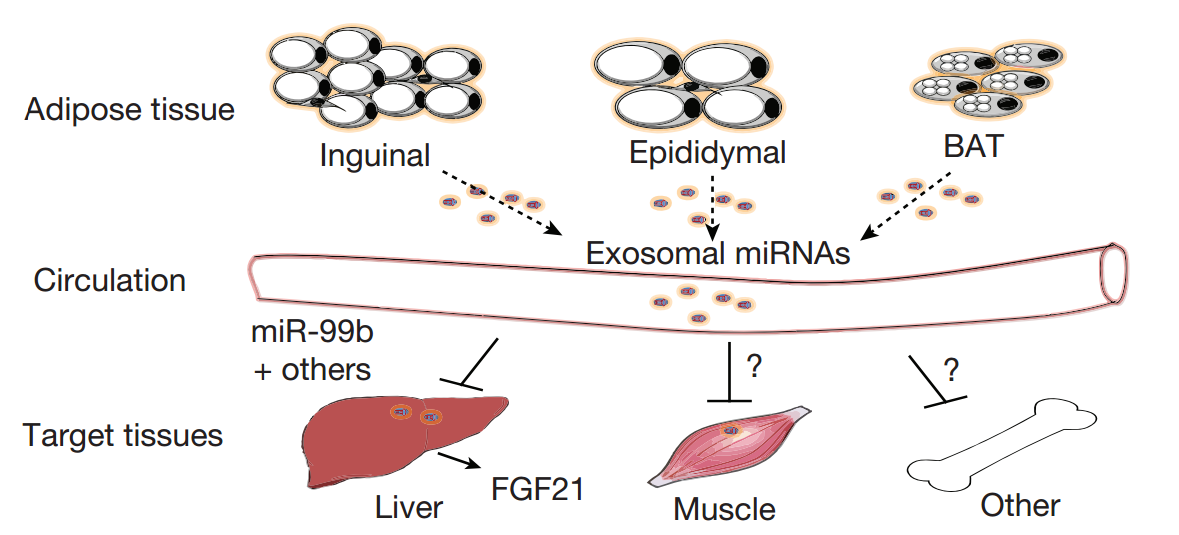
- (2017) Thomou, T., et al. "Adipose-derived circulating miRNAs regulate gene expression in other tissues." Nature.
这是一篇关于脂肪外泌体miRNAs调控其他组织基因表达的研究性文章。通讯作者:哈佛医学院Ronald Kahn。
该研究利用脂肪组织特异性敲除microRNA合成关键酶Dicer的KO小鼠和人脂肪营养不良患者研究发现他们循环系统中外泌体miRNA的水平明显下降。为Dicer KO小鼠移植白色和棕色脂肪组织可以恢复许多循环miRNA的水平,同时可以改善葡萄糖耐受、降低肝脏Fgf21 mRNA水平和循环中FGF21水平。通过对Dicer KO小鼠施用正常小鼠血清来源的外泌体可以得到相似的结果。在一只小鼠棕色脂肪组织中表达人特异性miRNA,通过抑制血清外泌体可以调控另一只小鼠肝脏中3’UTR报告基因。从而证明,脂肪组织外泌体miRNA调节远端组织中基因表达的新作用形式。
外泌体资讯网 外泌体文献【Nature】合集