外泌体是细胞衍生的纳米囊泡(50-150 nm),介导细胞间通讯,并且是候选的治疗剂。然而,外泌体信息传递(例如mRNA)效率低、以及缺乏设计外泌体的方法阻碍了它们治疗干预的发展。来自瑞士的研究人员报告了一套EXOsomal转移到细胞(EXOtic)的设备,可以在设计的哺乳动物细胞中高效定制生产设计好的外泌体。这些在外泌体生产细胞中的遗传编码装置增强了外泌体的产生、特异性的mRNA包装以及将mRNA递送到靶细胞的胞质溶胶中,从而实现有效的细胞间通讯而无需浓缩外泌体。植入活小鼠中的工程化生产细胞可持续地将mRNA递送至大脑。在体外和体内模型中,设计的外泌体通过治疗性过氧化氢酶mRNA的递送减轻帕金森病的神经毒性和神经炎症。这些研究结果表明EXOtic装置具有用于RNA递送治疗应用的潜在用途。
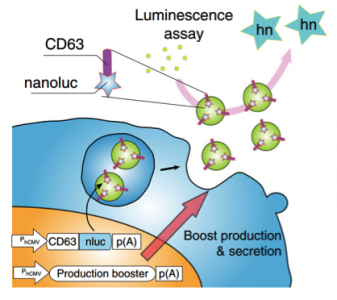
为了通过增加外泌体的生物合成和分泌来促进外泌体产生,研究人员首先在HEK-293T细胞中进行筛选,找到了增强外泌体产生的基因。具体来说,通过将nanoluc(nluc)(一种小而有效的生物发光报告基因)融合到CD63的C端(最广泛使用的外泌体标志之一)来制备报告系统。该报告基因与编码增强外泌体生产候选物的质粒共转染,逐步离心去除掩蔽信号后测量细胞培养上清液中的发光。研究人员鉴定了STEAP3(参与外泌体生物合成)、syndecan-4(SDC4;支持内体膜形成多泡体的出芽)和L-天冬氨酸氧化酶片段(NadB;可能通过调节柠檬酸循环促进细胞代谢)作为潜在的合成外泌体生产促进剂。这些基因的组合表达显著增加了外泌体产生,确保转染细胞以固定比例接受所有增强基因的三顺反子质粒载体(pDB60,以下称为外泌体生产增强剂)使上清液中的发光信号产生了15-40倍的增加(取决于细胞条件)。大部分发光信号来源于囊泡相关CD63-nluc,而不是来自可溶性nluc。研究人员还通过使用另一个报告分子CD9-nluc证实了加强因子的作用,表明加强剂对不同亚群外泌体的功效。此外,通过直接定量外泌体蛋白CD9和TSG101证实了外泌体生产的促进作用。最重要的是,纳米颗粒追踪分析(NTA)显示在不改变其大小分布的情况下,外泌体产量显著增加。总之,该方法有效地增加了外泌体的产生。
定量外泌体生产的发光系统模式图
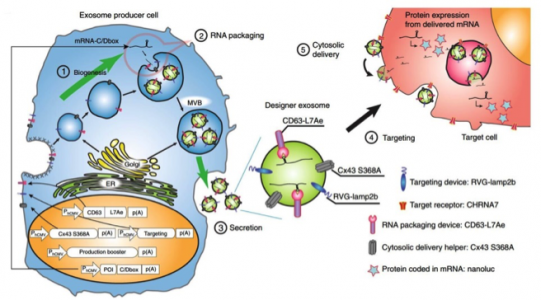
在建立了高效、稳定的促进外泌体产生的方法后,研究人员开发了一种将特定RNAs包装到外泌体(RNA包装装置)和一种帮助RNA输送到靶细胞胞浆中的装置(胞质输送辅助物)。对于RNA包装装置,我们关注。研究人员将与C/Dbox RNA结构结合的古细菌核糖体蛋白L7Ae与CD63的C端缀合,并将C/Dbox插入到报告基因的3'非翻译区(3'-UTR)中,通过3'-UTR区域L7Ae和C/Dbox之间的相互作用,编码报道蛋白nluc的转录物可以很好地整合进外泌体。作为一种潜在的细胞溶质传递辅助物,研究人员关注到间隙连接蛋白——connexin 43(Cx43),最近报道Cx43在外泌体中富集,以及通过形成六聚体通道增强外泌体到靶细胞的信息转移,并且存在持续活性的突变体S368A。将潜在的RNA包装装置和胞质传递辅助物与外泌体产生促进剂、编码在其3'-UTR中带有C/Dbox的nluc mRNA的报告系统、以及靶向模块RVG-Lamp2b一起共转染。据报道RVG-Lamp2b可通过与烟碱乙酰胆碱受体(CHRNA7)结合将外泌体靶向大脑。将含有设计外泌体的上清液(没有进一步浓缩外泌体)用于表达CHRNA7的HEK-293T细胞,在输送至靶细胞的nluc mRNA翻译后进行发光测定。结果显示,只有当所有组分都存在时才能检测到来自靶细胞的强烈发光,表明每个装置的功能。来自外泌体产生细胞的培养上清液在去除外泌体后发光显著降低,表明信号确实通过外泌体的转移而产生。C/Dbox重复次数显著影响传递效率(特别是在没有C/Dbox的情况下几乎检测不到发光)。而且,具有持续活性的Cx43 S368A突变体是比野生型Cx43更有效的胞质传递辅助物。至此,已经确定并开发了有效的基于外泌体的细胞间通信所需的组件,并将它们命名为EXOtic装置。
EXOtic装置示意图
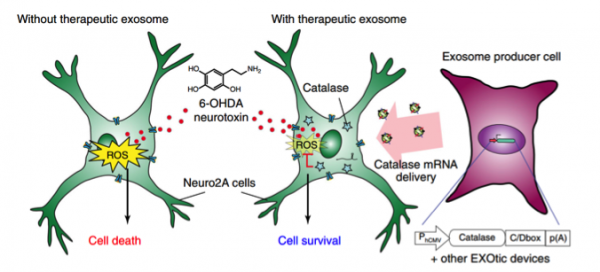
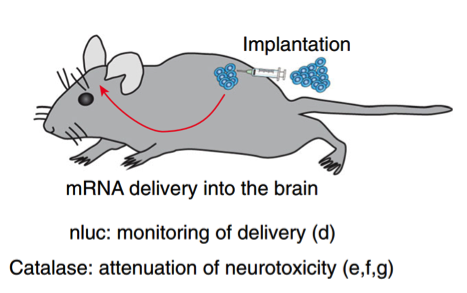
接下的研究就证明了通过这种EXOtic装置传递过氧化氢酶mRNA可缓解神经毒性。在小鼠模型中,细胞植入物可通过外泌体向大脑内传递过氧化氢酶mRNA,减轻帕金森病模型的神经炎症,从而达到对帕金森的治疗作用。
通过过氧化氢酶mRNA的传递在体外帕金森病实验模型中缓解神经毒性
工程化的外泌体生产细胞与Matrigel混合移植到小鼠皮下
总之,该研究设计的EXOtic装置是高效生产设计的外泌体的重要工具。经EXOtic装置工程化的可植入外泌体生产细胞开创了一种新的基于外泌体传递治疗性mRNA的治疗途径。
参考文献:
Kojima, R., et al. (2018). "Designer exosomes produced by implanted cells intracerebrally deliver therapeutic cargo for Parkinson's disease treatment." Nat Commun 9(1): 1305.