在美国,胰腺癌是第三位与癌症相关的死亡原因,中位总生存期小于1年,5年生存率仅为7.7%。在诊断时,大多数患者胰腺癌已经转移,处于不可治愈的疾病阶段。在目前的临床实践中,计算机断层扫描(CT)和磁共振成像(MRI)可用于鉴别肿瘤;然而,这些成像技术只能在疾病后期发展成可见肿块时才能检测到肿瘤,并且检测小转移瘤的能力较差。在早期的治疗阶段可以检测到胰腺癌的诊断技术的发展一直是人们非常感兴趣的课题,但是却面临重大挑战。
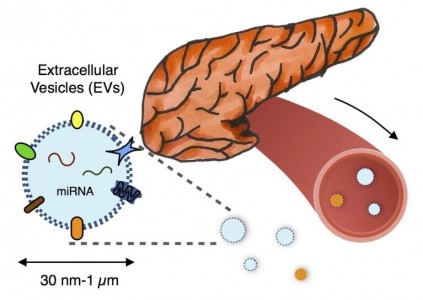
包括外泌体在内的循环胞外囊泡(EVs)最近受到关注,可利用容易获取的体液(血浆、尿液、唾液)中这些潜在的生物标志物来灵敏诊断疾病。EVs是循环囊泡(30nm-1μm ),它包含来自其母细胞的分子信息(mRNA、miRNA、DNA和蛋白质),并且可用于检测难以接近的肿瘤细胞的分子状态。相对于血液中循环分子(如蛋白质、无细胞DNA)。
EVs有三个关键医学诊断的优势:
(1)EVs对其内含的RNA产生保护作用,否则会在血液中降解的。
(2)包装在EVs中的多种RNA和蛋白质可用于执行多参数测量,从而可对特定疾病状态进行分类。
(3)可根据EVs表面上的蛋白质按照来源细胞对其进行分类,与血液中的分子标志物相比,可提高EVs成分测量的特异性。与循环肿瘤细胞(CTC)相比,EVs也具有关键优势。
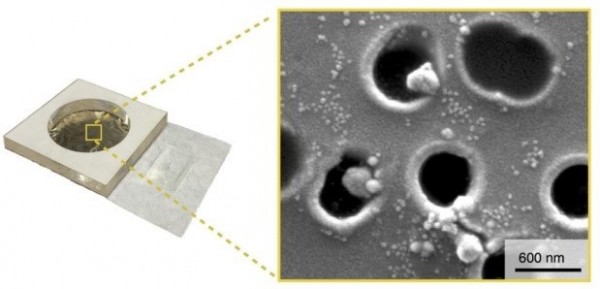
在血液中,EVs的浓度(10^8-10^10颗粒/毫升)比CTC的浓度(1-100个细胞/毫升)高,从而避免了计数错误。基于CTC的诊断还需要处理大量的血液(V> 10毫升),这也限制了CTC诊断应用。外泌体的主要限制是,由于其纳米尺寸的大小,应用传统的微流控技术来精确分类和检测它们一直是一个挑战,正如CTC取得巨大成功所做的那样。当微流体扩展到外泌体尺寸(尺寸比CTC小100倍)时,与通道横截面积成比例的纳米级器件的吞吐量下降了10000倍,并且在实际应用中变得太慢。为了克服这个问题,研究人员最近开发了轨道蚀刻磁性纳米孔(Track Etched Magnetic Nanopore, TENPO)分选技术,它通过纳米流体免疫磁性陷阱的大规模并行化来克服这个问题。TENPO的大规模并行化,可以实现在大体积流速(>10 mL/hr)下应用纳米流体分选的高精度,以及在任何一个孔隙堵塞时自动将流动转移至邻近孔隙,从而可以稳定地处理粗制样品。
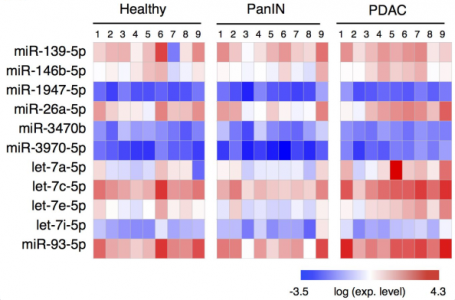
该研究发现的11种EV miRNAs标志物
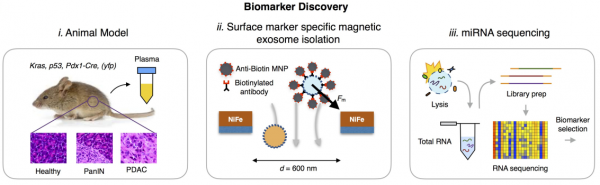
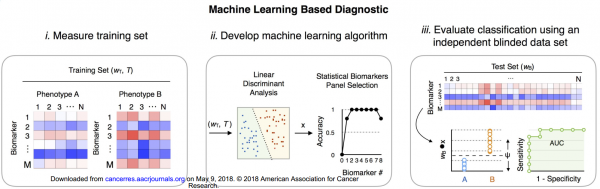
来自美国宾夕法尼亚大学的研究人员使用TENPO设备开发了一种EV miRNA生物标志物检测组件,可以诊断癌症的特定状态。鉴于验证患者样本中早期诊断的挑战,该研究使用KPC(Kras,p53,Pdx1-Cre)和KPCY(Kras,p53,Pdx1-Cre,yfp)鼠胰腺癌模型来进行临床前验证。使用KPC和KPCY小鼠,可以产生具有癌前病变(胰腺上皮内瘤变,PanIN)的小鼠,患有癌症的小鼠(胰腺导管腺癌,PDAC)和健康对照小鼠。这项研究的三个主要结果是:(1)确定了一组EV miRNA生物标志物(11种miRNAs),可以区分健康、PanIN和PDAC小鼠。(2)使用这组EV生物标志物预测哪些小鼠健康、PanIN或PDAC的机器学习算法,并在前瞻性收集的用户样品中评估该诊断方法。(3)确定了PDAC和PanIN小鼠中激活的关键信号传导途径,可以生物标志物与疾病状态的潜在机制联系起来。这些结果为使用EV miRNA分析和液体活检机器学习的可行性提供了强有力的概念验证支持。
课题思路:
第一部分 生物标志物的发现。利用胰腺上皮内瘤变、胰腺导管腺癌和健康小鼠模型,收集血浆,TENPO分离外泌体,提取外泌体miRNA进行测序分析,需找差异表达基因,找出可用作潜在生物标志物的miRNAs。
第二部分 基于机器学习的诊断。在机器学习算法中使用上述发现的EV生物标志物组来预测哪些小鼠是健康的、PanIN或PDAC,并且在前瞻性收集的用户盲法样品中评估该诊断准确性。
参考文献:
Ko J, Bhagwat N, Black T, Yee SS, Na YJ, Fisher SA,Kim J, Carpenter EL, Stanger BZ7, Issadore D. miRNA profiling of magneticnanopore-isolated extracellular vesicles for the diagnosis of pancreaticcancer. Cancer Res. 2018 May 7. pii: canres.3703.2017. doi:10.1158/0008-5472.CAN-17-3703. [Epub ahead of print]