近日,国家纳米科学中心蒋兴宇研究员、郑文富研究员带领的课题组发表了非病毒纳米载体递送的研究成果。他们开发了一系列非病毒的纳米载体,这些非病毒纳米载体可以高效递送CRISPR/Cas9系统到体内,为拓展这一强大基因编辑技术在生命科学及和临床应用领域的应用提供了新途径。相关研究成果“Thermo-triggered release of CRISPR-Cas9 system by lipid-encapsulated gold nanoparticles for tumor therapy” 作为Hot paper在Angew Chem Int Ed (57, 1491, 2018)发表。
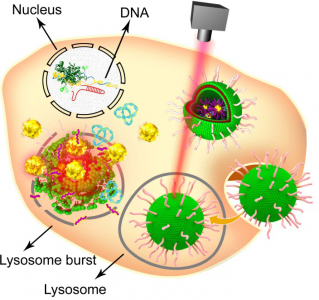
CRISPR/Cas9系统作为基因编辑技术的弄潮儿,具有巨大的潜在应用。但是目前大部分方法都是利用病毒载体导入到生命体,所以极大地限制了其在临床的应用前景。然而,病毒载体对宿主细胞可能产生致癌、致突变的风险,因此不能实现对CRISPR/Cas9系统的高效而安全的递送已经成为阻碍该技术临床应用的主要瓶颈。生物材料领域的科学家尝试着利用人工载体,例如脂质体、纳米材料等把编码的CRISPR/Cas9的质粒导入细胞。蒋兴宇课题组发展了基于金纳米颗粒-脂质体体系的光控释放纳米递送系统。他们将金纳米颗粒表面修饰TAT多肽,使纳米颗粒表面带正电荷,能够和带负电荷的表达Cas9蛋白和引导RNA的质粒(Cas9/sgRNA plasmid)结合,形成一个整体上带负电荷的“纳米核”,再在该“核”外包裹带正电荷的脂质体层(DOTAP, DOPE, Cholesterol)以及PEG2000-DSPE,形成一个具有核壳结构的纳米颗粒。该纳米颗粒可以通过细胞的胞吞及溶酶体逃逸途径进入细胞浆,在514纳米激光照射下金颗粒和TAT之间的金-硫键被打开从而将修饰在金颗粒上的TAT多肽解离下来,与TAT多肽通过静电相互作用结合的Cas9/sgRNA plasmid也随之解离下来并在TAT多肽的指引下穿过细胞核膜进入细胞核。利用该纳米载体,研究组在体外体内实现了对肿瘤癌基因polo-like-kinase-1(Plk-1)的靶向敲除并有效控制了肿瘤的生长和转移。
该工作是在前期工作的基础上发展而来的。在稍早的一些工作中,蒋兴宇课题组成功利用微流控系统高通量筛选了54种纳米递送系统并最终优选了脂质体系统成功递送了Cas9/sgRNA plasmid到动物体内,实现了对肿瘤Plk-1基因的高效敲除(NPG Asia Mater, 9, e441, 2017);在此基础上,他们又发展了基于金纳米簇-脂质体的递送系统并成功递送Cas9蛋白和sgRNA plasmid靶向动物的Plk-1基因,实现了对肿瘤的有效抑制(Adv Sci, 4, 1700175, 2017)。
蒋兴宇课题组的系列研究工作得到了国家自然科学基金委、中科院纳米先导专项以及中科院“创新团队国际合作伙伴计划”等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201708689
外泌体资讯网 国家纳米中心在CRISPR纳米递送研究中取得新进展