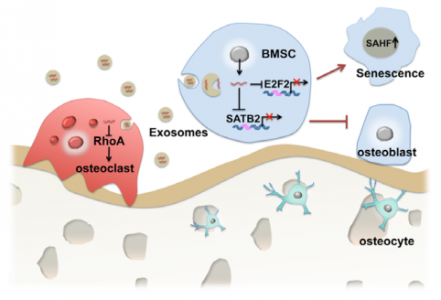
骨髓微环境中细胞衰老相关分子的改变是骨质疏松症的驱动因素之一。这些分子通过调节成骨细胞和破骨细胞活性来抑制骨形成并促进骨吸收,从而导致骨组织老化。来自南京医科大学江宏兵课题组在Aging Cell杂志发表论文,揭示了miR-31a-5p作为衰老相关的骨髓微环境的重要调节剂,影响成骨细胞和破骨细胞的分化,可能作为与衰老有关的骨质疏松症的潜在治疗靶点。
骨组织老化的特征是骨形成的减少和骨吸收的增加,通常会导致诸如骨质疏松症等疾病。成骨细胞形成骨骼与破骨细胞的骨吸收之间的平衡对维持骨量是重要的。新的证据表明,单核细胞、巨噬细胞、破骨细胞与骨髓基质细胞(BMSCs)成骨细胞之间的相互关系在骨质疏松症的病理学中起着至关重要的作用。随着机体衰老,具有衰老相关表型分泌(SASP)的分子被衰老细胞分泌到骨微环境中。这些分子减弱成骨分化以及促进BMSCs的成脂分化和衰老,这被认为是骨质疏松性骨丢失的主要原因。重要的是,这些SASP成分可能在BMSCs和破骨细胞之间传递信号,从而调节骨重塑的状态。然而,骨髓间充质干细胞功能障碍和BMSCs与破骨细胞间通讯的分子机制还不完全清楚。
的微miRNA是一类短的非编码RNA,作为细胞中基因表达的关键转录后阻遏物发挥作用。它们可以通过结合特定mRNA的非翻译区(UTR)来抑制靶基因水平,并因此降解mRNA或抑制翻译过程。已观察到miRNA参与多种生物学过程,特别是骨重建。研究表明,几种miRNA作为SASP的一个组成成分被释放到骨微环境中,并参与骨重塑过程中的成骨和破骨细胞生成。然而,大多数miRNA只在细胞内进行了分析研究,很少有研究关注miRNA在细胞外环境中的作用。此外,分泌到细胞外环境中的miRNA在没有保护时容易被降解。因此,miRNA介导的骨形成和骨吸收在骨组织老化中的相关性作用仍然不是十分清楚。
外泌体是细胞来源的磷脂膜包被的囊泡(直径40-150nm)。外泌体通过哺乳动物细胞的外排作用从细胞分泌出来。这些囊泡可能含有蛋白质以及mRNA和miRNA并具有特定的货物。一旦分泌到细胞外环境中,外泌体就被证明可以将它们的货物运送到靶细胞,保护货物在运输过程中免受降解。因此,骨髓间充质干细胞和破骨细胞之间的相互联系可能取决于骨髓微环境中的外泌体miRNA的穿梭,参与调节骨重建。课题组前期的研究表明BMSCs中的microRNA-31a-5p(miR31a-5p)通过SATB2途径调节牙齿的成骨分化。以前的结果也表明SATB2改善了老年人BMSCs的干细胞能力和成骨分化。另外,据报道,miR-31a-5p直接靶向骨相关标志物,例如RUNX2、OSX和DKK1等。此外,据报道,miR-31a-5p表达调节可用于调节与衰老相关的病理状态如癌症和衰老过程,这突出了miR-31a-5p在细胞衰老中的重要作用。此外,根据以前的研究,miR-31a-5p通过靶向RhoA来控制破骨细胞形成并促进T细胞中IL-2的产生。因此,这些发现暗示来自BMSC的miR-31a-5p可能调节成骨细胞生成和破骨细胞生成。
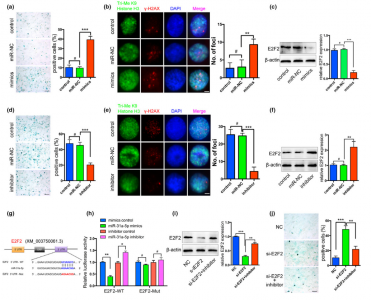
研究人员在老龄大鼠的BMSCs中鉴定了高表达的miR-31a-5p,并探讨了其通过外泌体分泌调节BMSC和破骨细胞的作用。研究结果表明,来自老年大鼠的BMSC表现出骨生成降低和衰老表型增加,这与miR-31a-5p的上调相关。重要的是,这是miR-31a-5p调控细胞衰老机制的首次报道。
图:miR-31a-5p抑制BMSC通过E2F2通路对衰老表型的恢复
参考文献:Xu R, Shen X, Si Y, Fu Y, Zhu W, Xiao T, Fu Z, Zhang P, Cheng J, Jiang H. MicroRNA-31a-5p from aging BMSCs links bone formation and resorption in the aged bone marrow microenvironment. Aging Cell. 2018 Jun 12:e12794.