作者:土豆
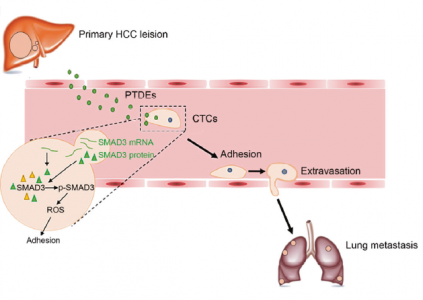
肝细胞癌(HCC)是一种致命的转移肿瘤类型,关于HCC转移的机制尚不完全清楚。在这项发表于Oncogene杂志的研究中,来自浙江大学医学院梁廷波、白雪莉课题组的研究人员使用体内和体外模型,发现原发性肿瘤来源的外泌体(PTDEs)通过调节循环肿瘤细胞(CTC)增殖和粘附促进肺转移形成,并揭示了PTDE介导SMAD3-ROS信号通路诱导细胞粘附的分子机制。
肝细胞癌(HCC)是世界上最常见的癌症之一,特别是在包括中国在内的发展中国家。大多数HCC患者死于肿瘤转移,其机制尚不清楚。最新的转移模型证明肿瘤的转移来源于原发肿瘤的循环肿瘤细胞(CTC)。然而,原发肿瘤与转移瘤之间的关系尚不清楚。虽然关于肿瘤稳态的争论持续了一个多世纪,但临床研究表明,手术对转移的发展可能与密切有关。在特定部位如果只有单个CTC或含有少量癌细胞的CTC簇在血管中存在,它们会遭受局部免疫细胞的攻击在内的环境影响,因此这些癌细胞的存活是很困难的。因此原发性肿瘤可能为转移灶的形成还会提供额外的支持。最近的研究为这一假设提供了证据。例如,原发性肿瘤来源的外泌体(PTDEs)可以通过诱导免疫抑制、纤维化或炎症在预先确定的转移器官中产生转移前的微环境。然而,很少有研究关注PTDEs对CTC的影响。
CTC附着到血管内层是癌细胞外渗和随后转移灶的形成必不可少的步骤。对CTC粘附的干扰可以破坏CTC的定植。活性氧(ROS)是细胞粘附的重要调节因子,并且在CTC中观察了ROS水平升高。高ROS水平与HCC中增强的侵袭性和转移相关。然而,在循环的HCC细胞中,ROS和CTC粘附的调节在很大程度上是未知的。
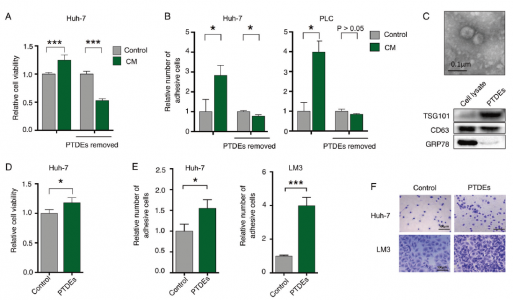
外泌体是体内和体外大多数细胞类型分泌的一种囊泡,直径约为50 nm。它们中含有许多生物大分子,包括蛋白质和RNA,可以在细胞之间转移。在转移中,CTC和原发性肿瘤来源的外泌体(PTDE)相互接触的机会增加。因此,原发性肿瘤和CTC之间的PTDE介导的通信是有可能的。在本研究中,体外和体内数据显示HCC细胞以旁分泌和自分泌的方式促进癌细胞增殖和肺转移形成。研究人员发现HCC衍生的外泌体介导了这种现象,并观察到在这些恶性外泌体存在下细胞粘附加强。随后进一步确定了活性氧(ROS)能调节粘附分子。有趣的是,已附着的HCC细胞释放了含有SMAD3蛋白和mRNA的外泌体,这些外泌体被递送到其他HCC细胞并促进它们的粘附。这些外泌体在受体HCC细胞中诱导SMAD3信号传导并增加其粘附能力。此外,研究发现HCC患者外周血中存在SMAD3富集的外泌体,其水平与原发肿瘤的疾病分期和SMAD3表达有关。该研究提出了原发性HCC促进转移形成的可能机制,并揭示了SMAD3在外泌体介导的原发性和循环性HCC细胞之间通信中的作用。
图:PTDE促进HCC细胞的增殖和粘附
参考文献:Fu Q, Zhang Q, Lou Y, Yang J, Nie G, Chen Q, Chen Y, Zhang J, Wang J, Wei T, Qin H, Dang X, Bai X, Liang T. Primary tumor-derived exosomes facilitate metastasis by regulating adhesion of circulating tumor cells via SMAD3 in liver cancer. Oncogene. 2018 Jul 10. doi: 10.1038/s41388-018-0391-0.
点击下方阅读原文,下载原文文献。
原文链接:http://www.exosome.com.cn/thread-2913-1-1.html