作者:企鹅
自闭症谱系障碍(ASDs)在男性中比在女性中多四倍,但其潜在的机制却知之甚少。我们对携带Chd8杂合突变(Chd8+/N2373K)的小鼠的性别间差异进行了表征。这是一种强大的ASD风险基因,可编码一种染色质重塑蛋白。这种变异首先在人类CHD8 (Asn2373LysfsX2)中鉴定出来。尽管雄性突变小鼠在幼崽、幼年和成年期表现出一系列异常行为,包括增强的寻求母亲超声波发声,增强对重聚母亲的依恋和隔离诱导的自我梳理,而雌性个体则没有。这种行为差异与神经元活动、突触传递和转录组学特征的性别间差异有关。雌性小鼠基线神经元兴奋受到抑制,增强的抑制性突触传递和神经元放电,以及与细胞外囊泡和细胞外基质相关的基因表达增加。最近Nature Neuroscience上在线发表的一篇研究结果表明,人类CHD8突变导致小鼠从转录到行为上的性别差异变化。
下面主要为大家介绍细胞外膜泡、外泌体相关部分内容。若需研读全文,请至官网或外泌体之家论坛同名贴下载。
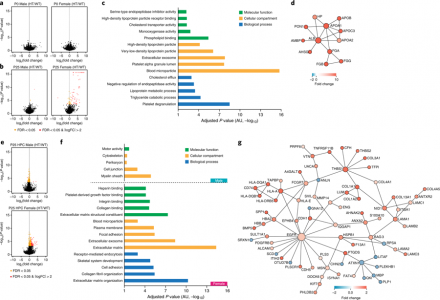
第25代(P25)雌性个体中96个差异表达基因(DEGs, differentially expressed genes)的DAVID分析揭示了与细胞外囊泡相关的GO功能富集,包括血液微粒(microparticles)和细胞外泌体(exosomes),已知它们在正常和病理条件下介导细胞间通讯。DEGs还与血小板活化有关,其促进免疫调节剂和外周BDNF的释放,并且与严重抑郁有关。蛋白质-蛋白质相互作用(PPI)分析揭示了蛋白质相互作用网络,包括载脂蛋白。
因为Chd8+/N2373K海马体显示出性别差异的突触传递和神经元放电,研究人员分析了海马转录物和全脑转录物。P25 Chd8+/N2373K小鼠在雄性中显示130个DEGs,在雌性中显示245 DEGs。对于特定的GO,雄性DEGs最低限度地富集,而雌性DEGs则强烈地富集于“血液微粒”和“细胞外外泌体”,全脑结果相类似。
除ECM相关,研究人员对P25雌性Chd8+/N2373K全脑样本的DEGs分析揭示了与“微粒”和“外泌体”相关的功能。直径分别为100-1000和30-100 nm的微粒(或微泡)和外泌体是从不同细胞释放的细胞外囊泡,其携带各种组分(蛋白质、脂质、DNA和RNA)以在正常和疾病情况下介导细胞间通讯。脑微粒可以从神经元、神经胶质、内皮细胞和血小板中释放出来,并调节正常的大脑发育和病理过程。血小板也与P25雌性Chd8+/N2373K全脑相连,释放出多种免疫调节分子以及BDNF,并与重度抑郁症有关。然而,细胞外囊泡和血小板活化与ASD或性别差异的关联的报道还很少。
雄性和雌性Chd8+/N2373K小鼠的差异转录组如何促成突触、神经元和行为表型?一个直截了当的假设是,在P25雌性而非雄性海马体中明显上调的ECM相关基因与突触和神经元激发表型相关。类似地,在整个脑中,在P25雌性中上调的微粒、外泌体和血小板相关基因或在P25雄性中下调的突触相关基因可能有助于c-fos表型。值得注意的是,雄性的行为变化比雌性强,而雌性的转录组变化尤其是DEGs更强。雌性强烈的转录组学变化可能有助于c-fos染色显示的较低的基线神经元兴奋。
参考文献:
Jung, H., et al. (2018). "Sexually dimorphic behavior, neuronal activity, and gene expression in Chd8-mutant mice." Nature Neuroscience. IF=19.912