糖尿病患者需要长期的胰岛素治疗,临床上普遍采用胰岛素皮下注射,一日三次或更多,需要患者自行监测自身血糖水平,血糖很难保持平稳,易出现“峰-谷”现象,严重低血糖发生率较高。现已开发的新型胰岛素制剂多为口服,肺部吸入或鼻腔给药的非长效非智能制剂,或胰岛素储库皮下埋植剂等长效非智能制剂;短效的胰岛素智能释放制剂也有研究报道。因此开发能同时实现长效和智能释放的胰岛素递药系统,是亟待解决的世界性难题。
近日,四川大学在构建胰岛素长效智能递送系统研究领域取得突破性进展,研究成果“Erythrocyte-membrane-camouflaged nanoplatform for intravenousglucose-responsive insulin delivery”作为封面文章发表于Advanced Functional Materials杂志(DOI: 10.1002/adfm.201802250,IF=13.325),并被Advanced Science News作为研究亮点报道。文章的通讯作者是四川大学高分子科学与工程学院引进人才张凌副研究员和华西药学院专职博士后林箐博士,第一作者是博士研究生傅玉。
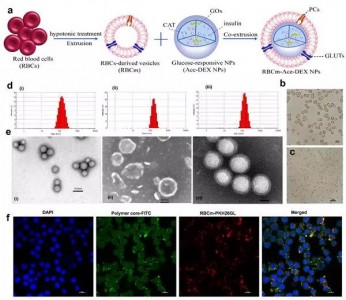
图1、该纳米递药系统的构建示意图及形态表征
(a)“核-壳”结构纳米递药系统的构建过程:载有胰岛素、葡萄糖氧化酶(GOx),过氧化氢酶(CAT)的缩醛化葡聚糖纳米粒作为纳米递药系统的“内核”,并采用具有葡萄糖转运体(GLUTs)的红细胞膜进行表面修饰形成“外壳”。(b) (c)显微镜下红细胞和红细胞膜的形态特征。(d) (e)纳米粒子的粒径分布图和透射电镜图:(i) 缩醛化葡聚糖纳米粒, (ii) 经处理制备的红细胞膜and (iii) 红细胞膜包裹的缩醛化葡聚糖纳米粒。
一般而言,糖尿病的治疗需要长期监测血糖水平,通过控制饮食糖摄入、坚持体育锻炼、胰岛素治疗等多种手段相结合来维持血糖量正常。根据发病机制的不同,糖尿病主要分为I 型糖尿病和II 型糖尿病,两者皆不同程度地依赖于长期胰岛素治疗。通常胰岛素的给药由患者自行餐前皮下给药,一日三次或更多;这种给药方式,不但顺应性差,还会带来一系列问题,比如,由于注射剂量无法智能调节可能较易引起低血糖症状、注射部位局部的高胰岛素血症、脂肪萎缩或脂肪增生等。近20年来,国内外有众多学者致力于胰岛素新剂型的开发,给药方式涉及皮下注射、口服、经鼻、经肺、经皮、皮下埋植等。但这些方式很大程度上尚不能同时实现智能响应、快速释放、长效循环和安全准确等方面的诉求。因此,设计并构建一种静脉注射的能够根据患者血糖水平智能释放胰岛素的长效给药系统,是临床胰岛素治疗糖尿病的迫切需要。
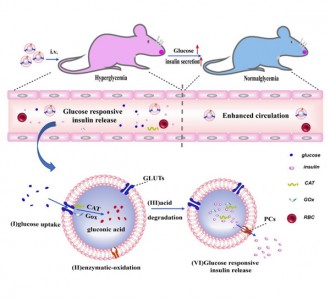
图2、静脉注射给药后该纳米递药系统在体内作用过程的示意图
针对这些问题,四川大学高分子科学与工程学院从英国曼切斯特大学引进的张凌副研究员与华西药学院专职博士后林箐博士进行了合作研究,首次发表文章报道了由酶促反应介导胰岛素智能释放的静脉注射长效递药系统。该项研究首先对生物相容性良好的天然高分子葡聚糖进行结构修饰,合成了pH敏感的缩醛化葡聚糖,并以此为载体,搭载胰岛素及介导葡萄糖智能响应的相关酶系,构建具有葡萄糖响应性能的高载量胰岛素纳米内核(NPs);然后采用具有天然血液长循环特性和优良生物相容性的活性红细胞膜包裹NPs,进行表面修饰赋予该纳米递药系统体内长效循环的性能,从而构建了胰岛素长效智能释放给药系统(图1)。静脉注射给药后,当血糖正常时该纳米系统由于红细胞膜的掩护能在血液循环系统中稳定存在,当血糖升高时,红细胞膜上的葡萄糖转运体(GLUTs)将血液中的葡萄糖转运到纳米递药系统内部,该纳米粒内部的葡萄糖氧化酶系(葡萄糖氧化酶(GOx),过氧化氢酶(CAT))催化葡萄糖转化为葡萄糖酸,降低了血液中由红细胞膜构成稳定封闭的微环境的pH,从而引发载药基质缩醛化葡聚糖的酸降解反应,及时释放胰岛素,到达调节血糖的目的(图2)。本课题的开展将为长效智能释放胰岛素新剂型的研发提供坚实的科学基础和应用价值。
外泌体资讯网 四川大学在胰岛素长效智能释药系统研究方面取得重要进展